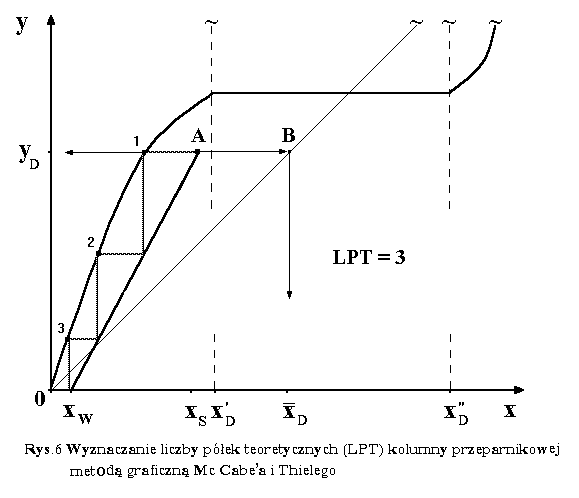
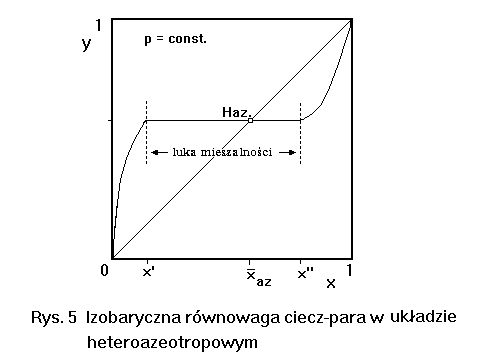|
Lotne substancje organiczne (LSO), w węższym znaczeniu używanym w technologii chemicznej i ochronie środowiska, to takie (zazwyczaj ciekłe) związki organiczne, stosowane w procesach technologicznych oraz będące w powszechnym użyciu (np. płyny chłodnicze w lodówkach czy benzyna ), które wskutek parowania mogą powodować straty materiałowe w produkcji lub/i szkodzić środowisku naturalnemu przenikając jako zanieczyszczenia do atmosfery. Łatwo przenoszone na duże odległości i rozprzestrzeniające się na znaczne obszary zanieczyszcenia atmosfery mogą stanowić zagrożenie nawet w skali globalnej.Według ocen różnych badaczy, emsja do atmosfery LSO z źródeł antropogennych (t.j . związanych z działalnością człowieka) na początku lat 90-tych, w skali światowej, wynosiła od 25 do 50 mln t /rok. Około 1/2 tej ilości przypada na przemysł, a ok. 1/3 na transport. Do największych zagrożeń wywołanych emisją LSO należy niszczenie warstwy ozonowej Ziemi przez niektóre organiczne związki chloropochodne, fluorochloropochodne (freony) i fluorochlorobromopochodne (halony). Od ponad czterdziestu lat substancje te były na szeroką skalę stosowane jako czynniki chłodnicze w instalacjach domowych i przemysłowych, jako środki spieniające przy produkcji polimerów, środki rozpylające w preparatach aerozolowych, płyny gaśnicze oraz jako rozpuszczalniki. Wykrycie w początkach lat osiemdziesiątych niszczenia prez nie warstwey ozonowej, niosącego skutki o zasięgu globalnym, spowodowało w efekcie zawarcie w 1987r międzynarodowego układu , zwanego Protokołem Montrealskim, ustalającego rodzaje LSO szkodliwych dla warstwy ozonowej oraz terminy przerwania ich produkcji i całkowitego wycofania z użycia. Od 1993 r. Polska jest też sygnateriuszem Protokołu Montrealskiego. Innym rodzajem LSO, których emisja do atmosfery może mieć wpływ na ocieplenie klimatu wywołane t.zw. efektem cieplarnianym są węglowodory. Ich źródłem są wszystkie objekty związane z wydobyciem lub/i wytwarzaniem, składowaniem, przesyłaniem i użytkowaniem paliw gazowych i płynnych, przede wszystkim gazu ziemnego i benzyny. W procesach przemysłowych wiele ciekłych produktów pośrednich, kierowanych do dalszego przerobu, i surowych nieoczyszconych ścieków to wodne roztwory LSO. Używane jako reagenty w procesach przemysłu chemicznego i rafineryjnego oraz jako rozpuszczalniki także w innych dziedinach gospodarki, LSO obejmują liczną grupę związków, zróżnicowanych pod względem własności fizycznych i chemicznych, ceny oraz stopnia i rodzaju szkodliwości dla otoczenia. Oprócz wyżej wspomnianych węglowodorów i ich fluorowcopochodnych należą tu alkohole, ketony, estry, etery, aminy, fenole i szereg innych rodzajów związków. Również stężenie LSO w wodzie może się zmieniać w szerokich granicach. Wszystkie te aspekty są brane pod uwagę przy wyborze sposobu traktowania LSO zawartych w wodach poprodukcyjnych. Można tu wyróżnić dwa sposoby ogólne : ( I ) - polegający na rozkładzie LSO metodami biologicznymi bezpośrednio w środowisku wodnym, bez wydzielania, ( II ) - obejmujący wydzielanie LSO wybranymi metodami fizykochemicznymi w celu ich ponownego wykorzystania bądź zniszczenia przez spalenie. Sposoby rodzaju
( I ) stosuje się do LSO będących odpadami produkcyjnymi, ze względów technologocznych
lub/i ekonomicznych nie nadającymi się do dalszego praktycznego wykorzystania.
Informacje o metodach biologicznych oczyszczania ścieków są podane w Rozdz.
5.3 “Podręcznika do ćwiczeń z technologii chemicznej” [1 ] .
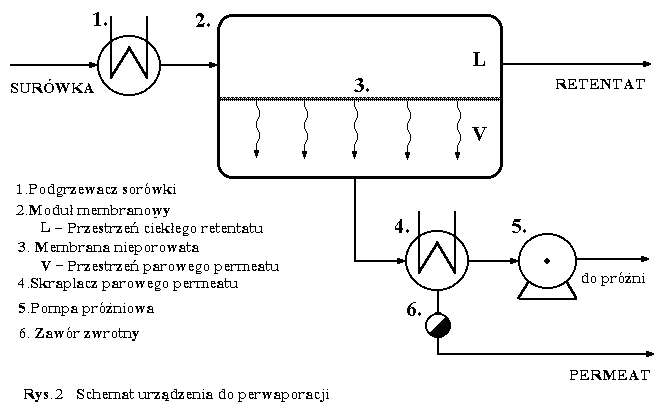
Do zachowawczego wydzielania LSO z wodnych płynów poprodukcyjnych i ścieków stosuje się klasyczne operacje rozdzielcze inżynierii chemicznej : adsorpcję, ekstrakcję i destylację, w różnych ich odmianach. Ostatnio też, praktyczne zastosowanie w tej dziedzinie znalazła perwaporacja - jedna z nowoczesnych membranowych metod rozdzielania mieszanin. O szczegółowym wyborze określonej metody i warunków jej prowadzenia decydują w pierwszej kolejności : 1) rodzaj
LSO (właściwości chemiczne i fizyczne),
Przy wydzielaniu składników użytecznych należy też uwzględnić ich termostabilność. Granice stosowalności
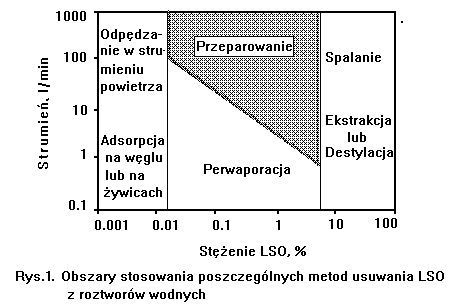
poszczegolnych metod ze względu na stężenie i wielkość strumienia są pokazane
na Rys.1.
|