| Urszula
Ochnik *)
ENZYMY I ICH UDZIAŁ
Enzymy,
fermenty, jest to grupa białek działających w komórkach i płynach ustrojowych
żywych organizmów jako biokatalizatory reakcji biosyntezy i rozkładu; ostatnio
odkryto, że niezależnie od białek aktywność biokatalityczną wykazują również
cząsteczki kwasów rybonukleinowych.
Enzymy mogą być zbudowane z samego białka (np. trypsyna, ureaza, rybonukleaza),
jednak w większości składają się z części białkowej ( apoenzym)
i niebiałkowej (małocząsteczkowe związki nieorganiczne, atomy metali, pochodne
witamin) tzw. grup prostetycznych i koenzymów.
Koenzymy
spełniają rolę przenośników elektronów, atomów lub grup chemicznych. Biorą
one udział w 2 kolejnych reakcjach enzymatycznych: w pierwszej pobierają
z jednego substratu grupę chemiczną, w drugiej oddają ją drugiemu substratowi,
odtwarzając się w pierwotnej postaci, po czym proces się powtarza; połączenie
koenzymów z przenoszoną grupą chemiczną odznacza się dużą reaktywnością.
Dzięki cykliczności procesu przenoszenia koenzymy mogą występować w żywej
komórce w ilościach równoważnych ilościom enzymów, choć reagują z substratami
stechiometrycznie. Trwałość połączenia apoenzymu w koenzymami jest różna;
jeśli koenzym łatwo dysocjuje, reakcje przenoszenia grup chemicznych na
koenzymy i z koenzymów katalizuje układ złożony z 2 enzymów o wspólnym
koenzymie; jeśli koenzym jest związany z enzymem trwale, enzym ten katalizuje
kolejno obie reakcje.
Enzymy katalizują reakcje termodynamicznie możliwe, zmniejszając jedynie energię aktywacji cząsteczek substratu, czyli energię niezbędną do przebiegu reakcji; przyspieszają dzięki temu osiągnięcie stanu równowagi reakcji (dla powiększenia rysunku kliknij na nim myszą - dotyczy to wszystkich ilustracji). 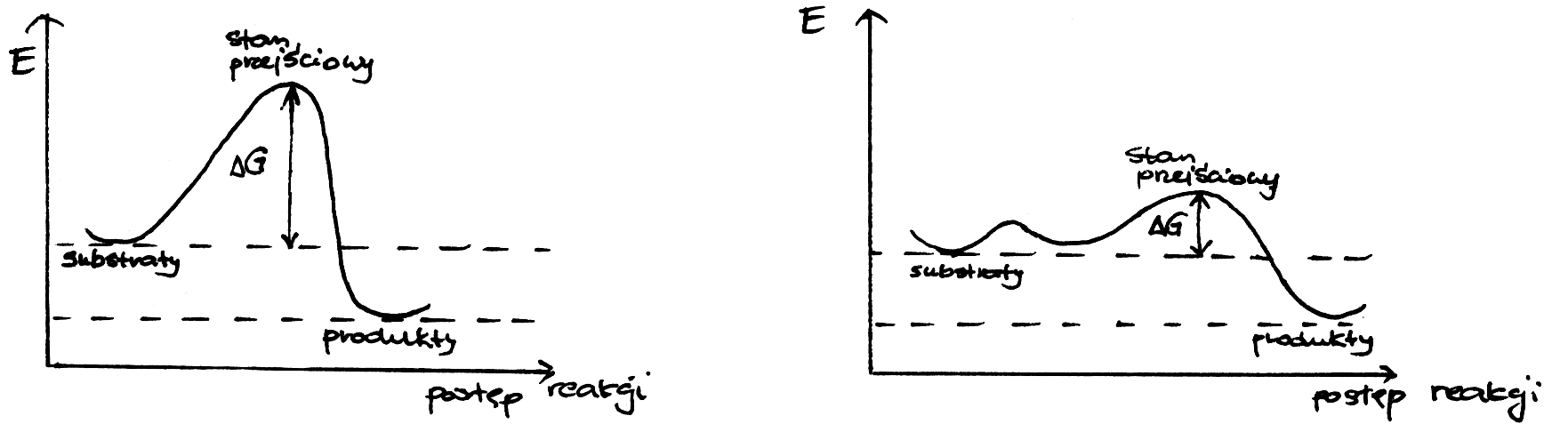 Wyróżniamy dwa typy mechanizmów łączenia się enzymu z substratem: -model klucza i zamka – gdzie enzym, tzn. jego miejsce aktywne, musi być dopasowany swoim kształtem do substratu by móc przekształcić go w produkt. Teoria ta jednak ma już tylko znaczenie historyczne 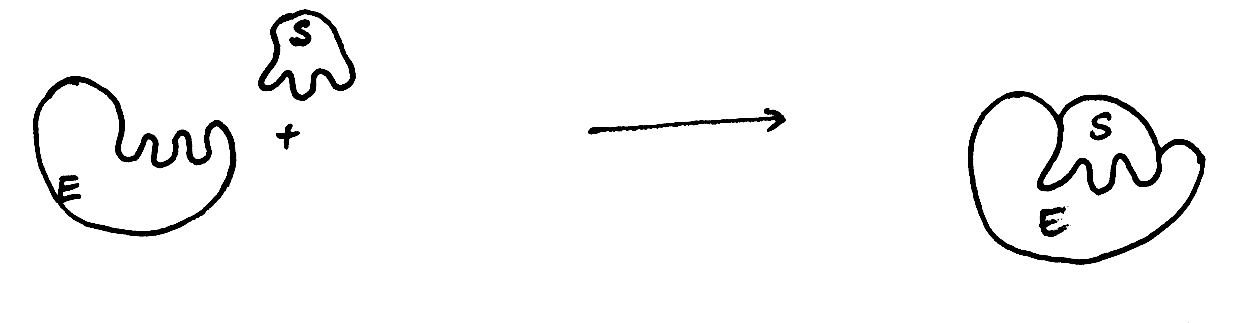  Stała Michaelisa Km to wielkość liczbowa, określająca stężenie substratu (w molach na litr roztworu), przy którym szybkość reakcji enzymatycznej jest równa połowie szybkości maksymalnej, osiąganej przy wysyceniu enzymu substratem i niezależnej już od dalszego wzrostu jego stężenia. Model Michaelisa – Menten opiera się na następującej koncepcji katalizy enzymatycznej: 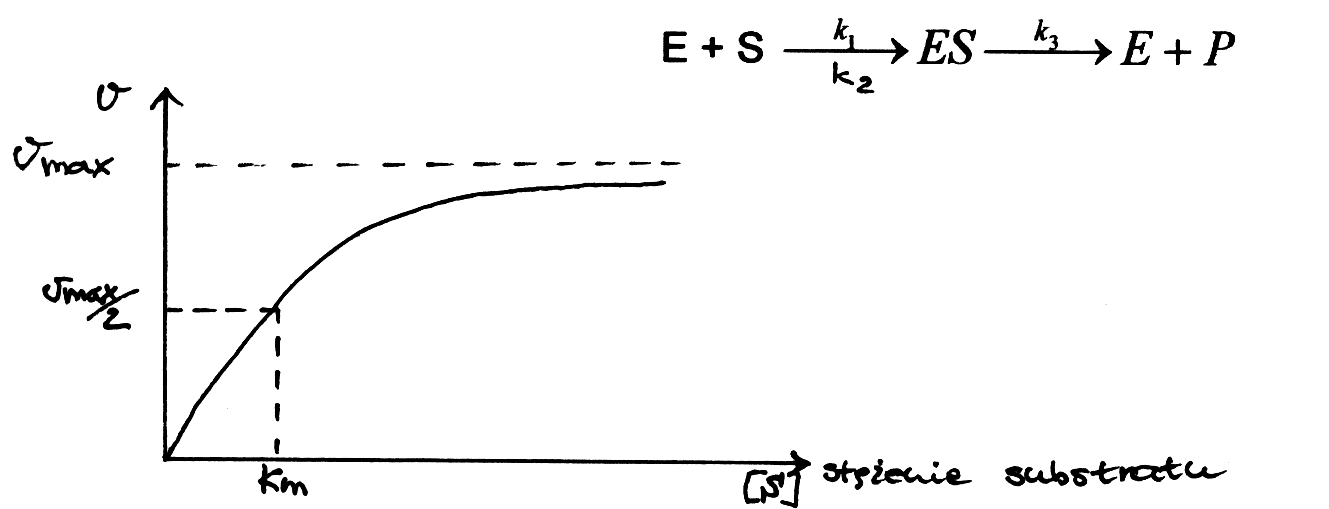 Szybkość reakcji zależy nie tylko od stężenia enzymu i substratu, lecz także od: - temperatury (optimum działania enzymu zwykle mieści się w granicach 30–40°C),Istnieje wiele typów cząsteczek , które są zdolne do zakłócania aktywności danego enzymu. Każda cząsteczka działająca bezpośrednio na enzym w kierunku zmniejszenia jego aktywności katalitycznej jest określana jako inhibitor. Pewne inhibitory enzymów są normalnymi metabolitami komórkowymi, które hamują dany enzym w ramach naturalnej metabolicznej kontroli odpowiedniego szlaku. Inne inhibitory mogą być substancjami obcymi dla organizmu, takimi jak toksyny i leki, i w tym przypadku hamowanie enzymu może mieć działanie terapeutyczne , ale również letalne. Rozróżnia się dwa główne typu inhibicji : - nieodwracalną - odwracalną Inhibicję odwracalną można podzielić na: 1) kompetycyjnąInhibicja nieodwrcalna polega na wiązaniu się inhibitora i enzymu w sposób trwały , nieodwracalny, często tworząc wiązania kowalencyjne z resztami aminokwasów, znajdującymi się w miejscu aktywnym lub jego pobliżu i w ten sposób inaktywują enzym na stałe. W wiązaniu tym biorą udział reszty Ser i Cys mające , odpowiednio, reaktywne grupy -OH i -SH . Przykładem może być związek diizopropylofluorofosforan ( DIPF) , składnik gazów bojowych (soman) działający na układ nerwowy, reaguje z resztą Ser w miejscu aktywnym enzymu esterazy acetylocholinowej, nieodwracalnie hamując enzym i uniemożliwiając przekazywanie impulsów nerwowych. 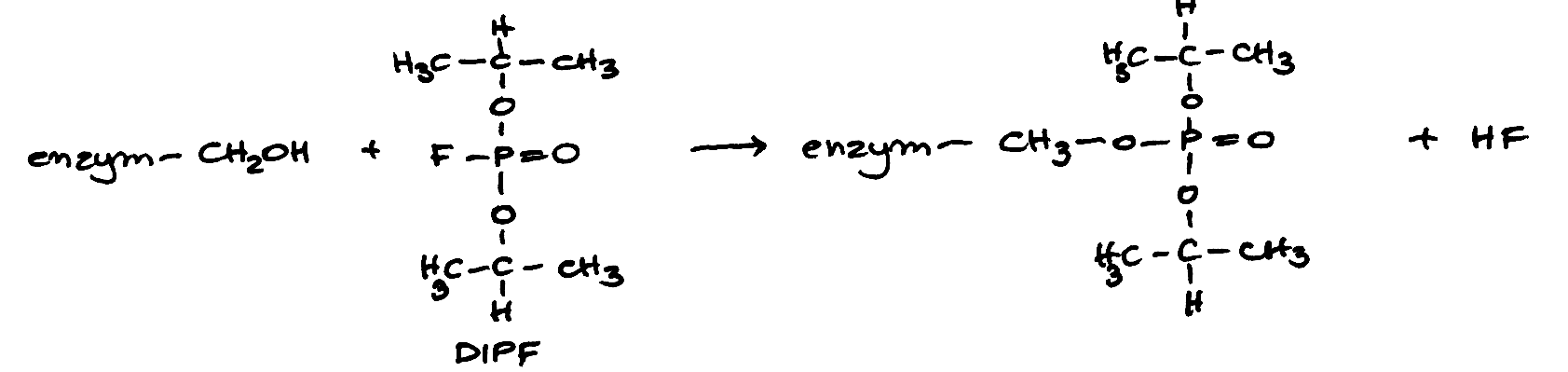 Przy dużych stężeniach substratu działanie inhibitora kompetucyjnego zostaje przezwyciężone , ponieważ duże stężenie substratu będzie z powodzeniem współzawodniczyć z cząsteczką inhibitora o wiązanie się w miejscu aktywnym. Nie nastąpi więc żadna zmiana w wartości Vmax enzymu , ale w obecności inhibitora kompetycyjnego zmniejsza się powinowactwo enzymu do jego substratu i dlatego wratośc Km wzrasta. Przykładem hamowania kompetycyjnego może być dehydrogenaza bursztynianowa. Enzum ten używa bursztyniany jako substratu i jest hamowany kompetycyjnie przez malonian, który różni się od bursztynianu posiadniem tylko jednej, a nie dwóch grup metylenowych. 

 Efektu inhibitora niekompetycyjnego nie można przezwyciężyć przez zwiększanie stężenia substratu i dlatego zmniejsza się wartość Vmax . W inhibicji niekompetycyjnej powinowactwo enzymu do substratu pozostaje nie zmienione, a więc wartość Km nie zmienia się . Przykładem inhibicji niekompetycyjnej jest działanie pepstatyny na enzym reninę . 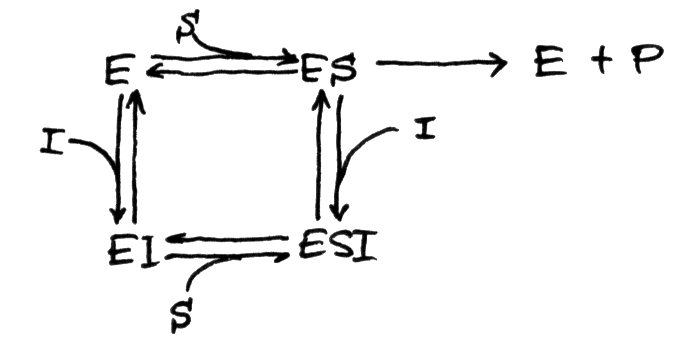 Międzynarodowa jednostka enzymu (U) jest to taka ilość enzymu, która katalizuje przekształcenie 1 mikromola substratu w ciągu 1 min w temp. 30°C przy nasyceniu enzymu substratem i przy optymalnym pH dla jego aktywności. Oprócz enzymów z jednym centrum aktywnym mamy także enzymy allosteryczne. Są to związki mające więcej niż jedno miejsce aktywne, które to miejsca kooperatywnie wiążą cząsteczki substratu, dzięki czemu związanie substratu w jednym miejscu aktywnym indukuje w enzymie zmianę konformacyjną, zmieniającą powinowactwo do substratu w innych miejscach aktywnych. Ten typ enzymów może występować w formie białka złożonego z wielu podjednostek, z których każda ma miejsce aktywne. Poza tym enzymy allosteryczne mogą być kontrolowane przez cząsteczki efektorowe (aktywatory i inhibitory), które wiążą się do innych miejsc niż miejsca aktywne i zmieniają szybkość aktywności enzymatycznej. Enzymy
wykazują rozmaitą swoistość katalitycznego oddziaływania na substraty.
Niektóre reagują tylko z jednym związkiem, inne są mniej swoiste i działają
na określoną grupę związków; swoistość enzymu zależy od budowy substratu,
który musi zawierać wiązanie ulegające atakowi danego enzymu oraz grupę
funkcyjną (lub grupy funkcyjne) umożliwiającą odpowiednie połączenie się
enzymu z substratem i zapoczątkowanie katalizowanej reakcji.
Podstawą klasyfikacji enzymów, wprowadzonej 1961 przez Komitet Enzymowy Międzynarodowej Unii Biochemicznej, jest rodzaj katalizowanej reakcji. Poszczególne klasy obejmują enzymy katalizujące następujące reakcje: 1) oksydo-redukcji ( oksydoreduktazy)Wszystkie nazwy systematyczne i większość potocznych nazw enzymów mają końcówkę -aza (amylaza, peptydaza, transferaza itd.). Enzymy są wykorzystywane w przemyśle do prowadzenia różnego rodzaju fermentacji, w lecznictwie służą jako leki (pepsyna, streptokinaza) Oznaczanie
różnych enzymów w tkankach i płynach fizjologicznych odgrywa rolę w diagnostyce
lekarskiej. Brak lub niedobór pewnych enzymów lub zmiana ich aktywności
w wyniku zmiany ich budowy jest powodem wielu schorzeń (np. albinizm,
fenyloketonuria,
galaktozemia,
methemo-globi-nemia).
Literatura: AUTHOR
Stryer, Lubert (1938- ).
AUTHOR
Kafarski, Paweł.
TITLE
Enzymy
: nomenklatura i klasyfikacja : zalecenia Międzynarodowej Unii Biochemicznej
z roku 1964 dotyczące nomenklatury i klasyfikacji enzymów wraz z ich jednostkami
i symbolami kinetyki enzymatycznej / tł. z ang. pod red. Tadeusza Korzybskiego.
A.E.
Humphrey, N.F. Millis, S. Aiba, "Inżynieria biochemiczna"
Urszula Ochnik - studentka III roku Wydziału Chemii UW w roku akad. 2002/2003
|