|
WODA
Tlenek wodoru, zwany zwyczajowo
wodą, składa się z tlenu i wodoru. Ich udział masowy w cząsteczce wynosi
11,19% dla wodoru i 88,81% dla tlenu. Samo wymieszanie tych 2 gazów nie
zapewnia reakcji między nimi; do zapoczątkowania syntezy jest konieczne
dostarczenie energii. Jednak po zainicjowaniu reakcji biegnie ona bardzo
szybko z wydzieleniem znacznych ilości energii: 10 g mieszaniny wybuchowej
(mieszaniny wodoru i tlenu w proporcjach objętościowych 2:1, nazwa pochodzi
od wybuchu, który towarzyszy reakcji) dostarcza energii wystarczającej
do zagotowania 0,5 dm3
wody.
Jak wygląda cząsteczka wody?
W rzucie na płaszczyznę ma wygląd trójkąta równoramiennego z atomem tlenu
w jednym narożu trójkąta i atomami wodoru w pozostałych dwóch. Boki tego
trójkąta mają długości: 1,013 x 10-10m (wiązanie H - O) oraz
1,63 x 10-10m (średnie odległości między atomami wodoru). Kąt
między wiązaniami H - O ma wartość 104°
27’, co odpowiada 1,82 rad. W trzech wymiarach cząsteczka wody ma kształt
tetraedru z atomem tlenu w środku i atomami wodoru oraz wolnymi parami
elektronowymi w wierzchołkach.
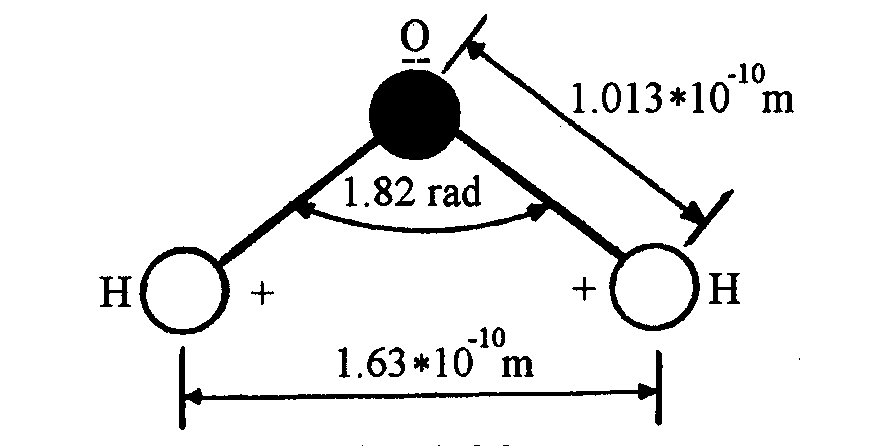
Cząsteczka wody widziana w
dwóch wymiarach
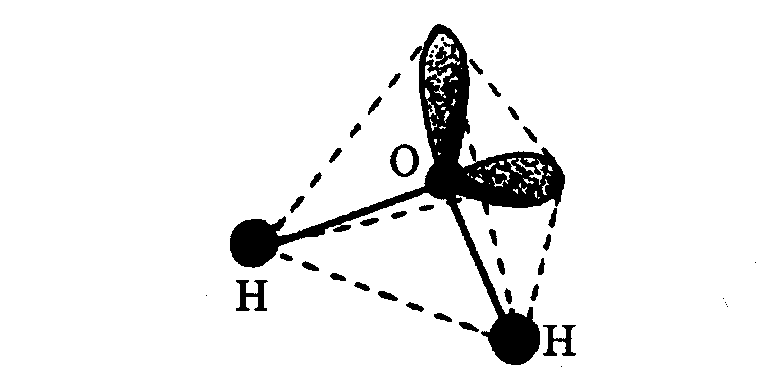
Cząsteczka wody widziana w
trzech wymiarach
W związku z różnicą elektroujemności
wodoru i tlenu wiązanie H - O jest wyraźnie spolaryzowane, a cała cząsteczka
ma charakter polarny; jest również dipolem. Wartość jej momentu dipolowego
wynosi 1,84D. Zgodnie z teorią Paulinga (teoria rezonansu kwantowo-mechanicznego)
rzeczywiste wiązania w cząsteczce wody są “wypadkową” czterech struktur
rezonansowych: struktury o wiązaniach czysto kowalencyjnych (udział ok.37%),
struktury o wiązaniach czysto jonowych pomiędzy kationami wodoru i dwuujemnym
anionem tlenu (udział struktury ok. 15%) i 2 struktur o charakterze kowalencyjno
- jonowym, w których jedno z wiązań H - O jest wiązaniem jonowym, a drugie
kowalencyjnym (udział tych struktur po ok. 24%).
Na atomie tlenu znajdują się
dwie wolne pary elektronowe. Oznacza to, że cząsteczka wody może tworzyć
cztery wiązania wodorowe: dwa przez tlen (a konkretnie przez jego wolne
pary elektronowe) i dwa przez atomy wodoru mogące oddziaływać z innymi
wolnymi parami elektronowymi. Te wiązania wodorowe są odpowiedzialne za
łączenie się cząsteczek wody w asocjaty i za powstawanie struktury lodu.
Cząsteczka wody może wykonywać
najróżniejsze ruchy. Może się przemieszczać (translacja), może się obracać
wokół osi przechodzącej przez środek atomu tlenu (rotacja), a także wykonywać
drgania względem wiązania H - O (oscylacje).
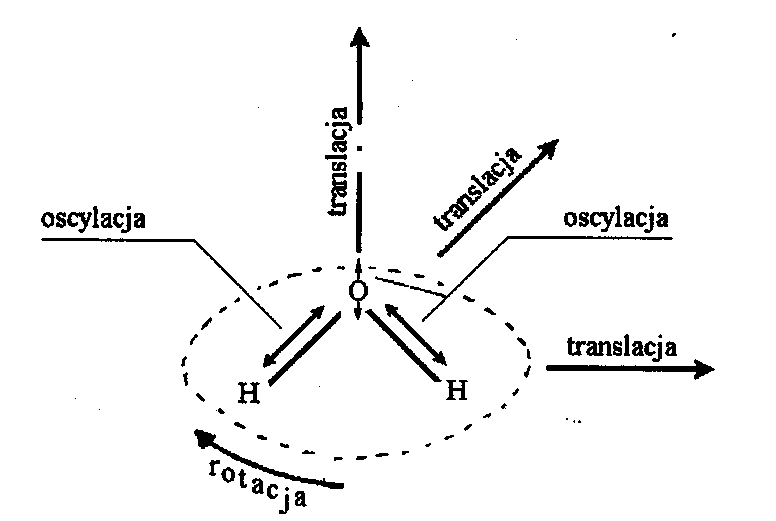
Możliwe ruchy cząsteczki wody
W każdym ze stanów skupienia
woda, choć ma nadal identyczny skład chemiczny i podobną strukturę (zawsze
część cząsteczek jest ze sobą zasocjowanych, co umożliwia wodzie jej ruchliwość),
zachowuje się w różny sposób. W stanie lotnym, do temperatur ok. 573K para
wodna zachowuje się podobnie jak zwykły gaz. Każda z cząsteczek wody może
samodzielnie istnieć; odległości między nimi są wystarczająco duże. Praktycznie
jedynymi oddziaływaniami są zderzenia na skutek bezwładnych ruchów cieplnych.
Struktura wody w fazie ciekłej
jest czymś pośrednim pomiędzy strukturą lodu i pary wodnej. W temperaturach
bliskich temperatury wrzenia cząsteczki wody zachowują się podobnie do
cząsteczek pary wodnej; ich ruchy są bezwładne. W temperaturach zbliżonych
do temperatury krzepnięcia poszczególne cząsteczki gromadzą się w zbiory
(asocjaty) przyjmując strukturę zbliżoną do struktury lodu. Jednak w każdej
temperaturze (pomiędzy tkrzepnięcia a twrzenia) oddziaływania
międzycząsteczkowe są słabsze niż w ciele stałym, lecz silniejsze niż w
gazie.
Cząsteczki wody w fazie stałej
zajmują określone pozycje w strukturze krystalicznej. Ich ruchy ograniczają
się do drgań wokół pewnych położeń równowagi.
W zależności od ciśnienia (i
temperatury) istnieje 8 odmian lodu różniących się właściwościami, np.
lód II i lód III maja większą gęstość niż lód I (zwykły), a lód VI i VII
temperatury topnienia powyżej 80°
C. Wszystkie odmiany poza lodem I istnieją w wysokich ciśnieniach.
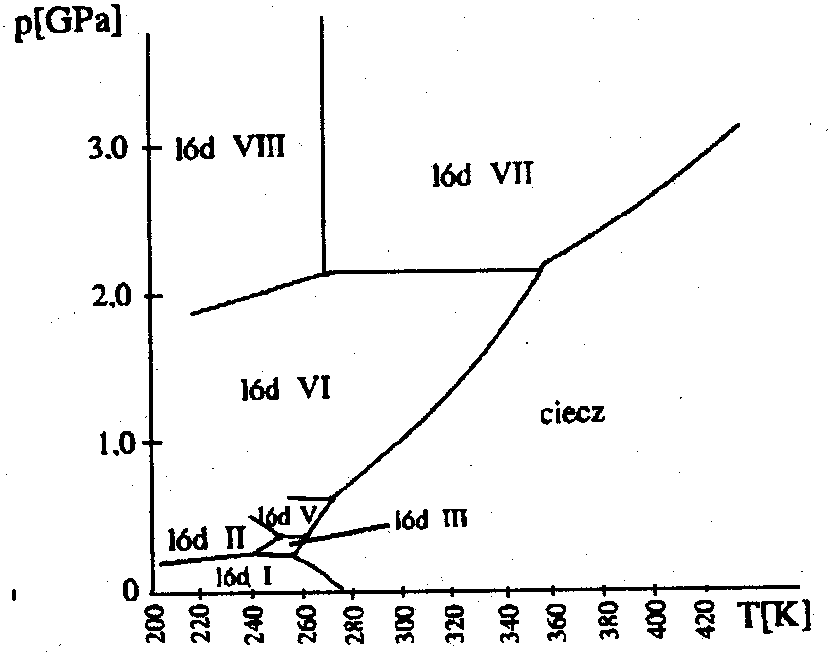
Diagram fazowy lodu
Jeszcze kilka słów o lodzie.
Lód wykazuje jedne z wyższych ciepeł topnienia w przyrodzie: w temperaturze
273K przyjmuje ono wartość 334,8kJ/kg. Wyższe ciepło topnienia ma tylko
glin. Ponadto temperatura topnienia lodu zmienia się wraz z ciśnieniem:
początkowo wraz ze wzrostem ciśnienia spada, by osiągnąć pewne minimum
dla p = 500 MPa, a następnie rośnie.
Stany skupienia i równowagi
między nimi opisuje tzw. diagram fazowy. W punkcie zwanym punktem potrójnym
(dla wody t = 273,16 K i p = 631,163 Pa) współistnieją lód, ciekła woda
i para wodna. Innym ciekawym punktem tej charakterystyki jest punkt określający
tzw. stan krytyczny. Opisuje on parametry (dla wody t = 647,31 K, p = 22,13
MPa) stanu, w którym nie trzeba dostarczać energii by przeprowadzić ciecz
w parę. W warunkach krytycznych faza ciekła i gazowa mają takie same gęstości,
napięcie powierzchniowe wody spada do zera, jej swobodna powierzchnia zanika.
Powyżej temperatury krytycznej nie można już skroplić gazu.
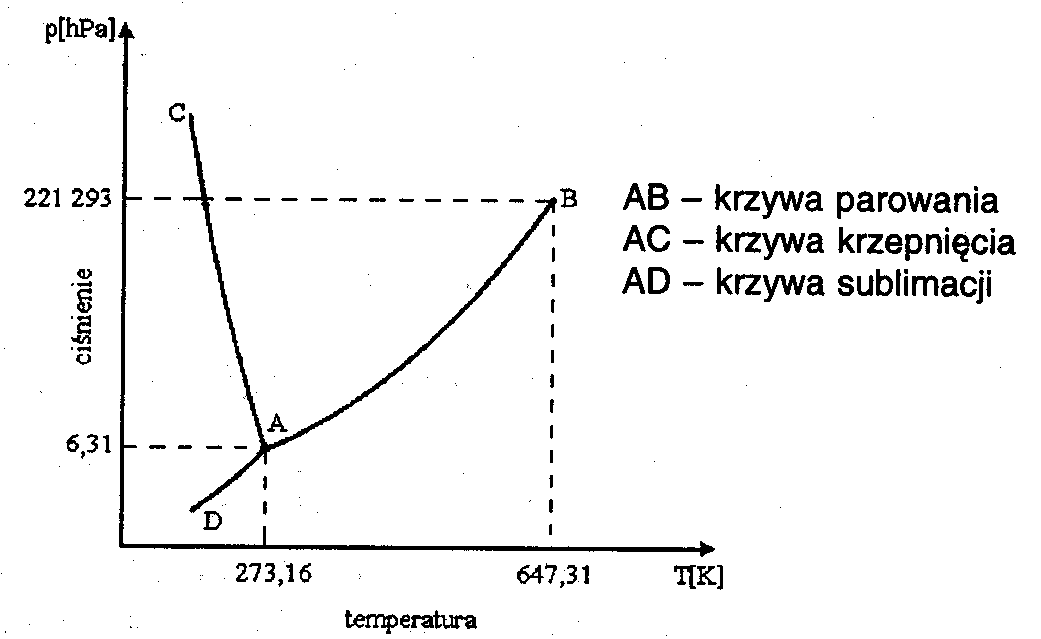
Diagram fazowy wody (zależność
temperatura ~ ciśnienie)
Woda paruje cały czas i to
niezależnie od temperatury. W temperaturach poniżej tkrzepnięcia
mamy do czynienia z sublimacją (bezpośrednim przejściem z ciała stałego
w stan gazowy). W temperaturze wrzenia w cieczy zaczynają się tworzyć pęcherzyki
pary początkowo przy ściankach naczynia, a następnie w całej objętosci.
Ciekawym zjawiskiem jest samo
parowanie wody: Ciepło tego zjawiska wynosi 2252,5 kJ/kg, z czego tylko
180kJ/kg jest zużywane na zwiększenie objętości przy przejściu w stan pary
(pokonanie ciśnienia powietrza; woda parując zwiększa swoją objętość 1650
razy). Pozostała ilość energii służy do rozbicia powiązanych ze sobą cząsteczek
wody w pojedyncze cząsteczki.
Temperatura wrzenia wody wzrasta
wraz z ciśnieniem. Dla ciśnień niższych od 1atm wrze ona w temperaturze
poniżej 100°C, dla
ciśnień wyższych powyżej tej temperatury. Czysta woda pozbawiona jakichkolwiek
rozpuszczonych w niej gazów wrze w bardzo wysokich temperaturach.
Gęstość substancji zależy od
ciśnienia i temperatury, a co z tego wynika, od stanu skupienia, w jakim
się znajduje. Gęstość lodu wynosi 916,8 kg/m3, następnie
w temperaturze topnienia zwiększa się do 999,868 kg/m3, rośnie
aż do temperatury 3,9834°C,
gdzie osiąga maksymalną wartość (pod normalnym ciśnieniem) 999,972kg/m3.
Następnie dalej spada. Przy wyższych ciśnieniach
gęstość wody cały czas rośnie.
Kolejną ciekawą właściwością
wody jest zmiana jej objętości właściwej. Woda w temperaturach od temperatury
topnienia do ok. 4°
C zmniejsza swoją objętość, co można wytłumaczyć stopniowym rozpadem większych
asocjatów, czyli zrywaniem niektórych wiązań wodorowych. W t=4°C
woda zawiera głównie dimery (H2O)2. Przy dalszym
ogrzewaniu rozpadają się one na pojedyncze cząsteczki, co zwiększa objętość
cieczy. Podczas topnienia zrywa się ok. 15% wszystkich wiązań wodorowych,
co powoduje zmniejszenie objętości. Dlatego też woda ma mniejszą objętość
niż lód.
Jak już wspomniano, w przedziale
temperatur od 273K do 277K objętość wody maleje, a gęstość rośnie. Zjawisko
to jest czasami nazywane efektem anormalnej rozszerzalności cieplnej. Można
to wytłumaczyć w następujący sposób. W coraz wyższej temperaturze uwolnione
ze struktury lodu cząsteczki wykonują coraz gwałtowniejsze ruchy cieplne
dążąc do coraz gęstszego upakowania osiągniętego właśnie w temperaturze
277K. Jednak ze względu na coraz intensywniejsze ruchy cieplne cząsteczek
to upakowanie zaczyna się rozluźniać. Właśnie to zjawisko tłumaczy rozkład
temperatur w zbiorniku wodnym w zimie.
Dla większości substancji ciepło
właściwe zależy od temperatury i wraz z jej wzrostem rośnie. Wyjątkiem
jest tu woda. W przedziale temperatur od 0°
C do 27°C ciepło właściwe
spada, osiąga w temperaturze t=27°
C minimum, by następnie rosnąć. Ta anomalia jest związana z wiązaniami
wodorowymi, które wraz ze wzrostem temperatury są rozrywane. Właśnie to,
a także wzrost energii kinetycznej i potencjalnej oscylacji atomów cząsteczki
wody powoduje wzrost ciepła właściwego wody. Woda ciekła posiada najwyższe
ciepło właściwe, wyższe nawet od ciepła właściwego lodu.
Ze względu na bardzo małe przewodnictwo
cieplne woda, a także lód są idealnymi izolatorami cieplnymi.
Kolejną własnością wody odróżniająca
ją od innych cieczy jest jej wysokie napięcie powierzchniowe. Wyższe wartości
napięcie powierzchniowe osiąga tylko dla stopionych metali. Jest ono związane
z oddziaływaniami międzycząsteczkowymi (zależnymi od temperatury) poprzez
wiązania wodorowe łączącymi cząsteczki wody w duże asocjaty. Wraz ze wzrostem
temperatury napięcie powierzchniowe wody maleje. Zjawiskiem związanym z
napięciem powierzchniowym jest menisk (określony kształt powierzchni wody).
Jego kształt zależy od wartości sił spójności i sił przylegania. Gdy siły
spójności są większe od sił przylegania tworzy się menisk wypukły (np.
woda w naczyniu szklanym pokrytym parafiną), gdy jest odwrotnie, tworzy
się menisk wklęsły (np. woda w szklanym naczyniu). Z kolei tworzenie menisku
wklęsłego pociąga za sobą zjawisko włoskowatości (wznoszenie cieczy w kapilarach).
Inną ważną cechą jest lepkość,
czyli tarcie wewnętrzne. Lepkość cieczy maleje wraz ze wzrostem temperatury,
co hamuje migracje cząsteczek wody w tkankach w niższych temperaturach.
W zasadzie, wodę można uważać przy umiarkowanych ciśnieniach za ciecz o
małej lepkości i ściśliwości. Wraz ze wzrostem ciśnienia lepkość rośnie
dość znacznie, co trzeba uwzględniać we wszelkich projektach instalacji
pracujących w wyższych ciśnieniach.
Mimo pozorów woda, o ile jest
bardzo czysta i pozbawiona wszelkich obcych jonów, jest izolatorem, tzn.
ma wykazuje bardzo duży opór właściwy. Jeszcze większy opór wykazuje lód.
Jednak obecność minimalnych ilości obcych jonów pochodzących z rozpuszczonych
w wodzie soli czy gazów znacznie zwiększa przewodnictwo wody. Ponadto przewodnictwo
rośnie wraz z temperaturą; zwiększa się wtedy dysocjacja wody na jony H+
i
OH-.
Woda jest ciecza
polarną. Oznacza to, że silnie ulega polaryzacji, a jej stała dielektryczna
zależy od temperatury. Cechą charakterystyczną cieczy polarnych jest tworzenie
przez ich cząsteczki asocjatów. W wodzie jest to związane z dipolowym charakterem
cząsteczek. Woda wykazuje również dużą wartość stałej dielektrycznej (w
t=0°C ma ona wartość
87,9, a w t=25°C 78,4).
To dzięki tak dużej wartości tej stałej woda jest rozpuszczalnikiem tylu
substancji jonowych, wywołując ich dysocjację.
Woda jest diamagnetykiem, czyli
jest wypychana z pola magnetycznego.
Obok “zwykłej” wody, H2O
istnieją jeszcze jej podstawione izotopowo odmiany. Podstawieniu izotopowemu
może ulegać zarówno wodór (otrzymujemy wtedy HDO lub D2O, zwaną
ciężką wodą oraz HTO, DTO czy T2O) jak i tlen (otrzymujemy H217O
lub H218O) oraz oba pierwiastki na raz. Wraz ze zmianą
izotopu na cięższy zmieniają się niektóre własności wody, jak np. gęstość,
objętość molowa, temperatura topnienia, temperatura wrzenia. Jest to związane
głównie z silniejszymi oddziaływaniami w podstawionej cięższym izotopem
cząsteczce. Wraz ze wzrostem masy zwiększa się stała siłowa wiązania tworzonego
przez dany atom, wiązanie staje się krótsze i silniejsze. Dotyczy to również
wiązań wodorowych. W tabeli podane są niektóre właściwości wody “zwykłej”
(H2O) i podstawionej deuterem, ciężkiej (D2O).
|
Właściwość
|
H2O
|
D2O
|
|
Masa cząsteczkowa [u]
|
18,016
|
20,016
|
|
Gęstość [g/cm3]
/w t=20° C/
|
0,9982
|
1,1043
|
|
Objętość molowa [cm3]
/w t=20° C/
|
18,048
|
18,126
|
|
Współczynnik załamania
światła /w t=20° C/
|
1,3330
|
1,3281
|
|
T topnienia [°
C]
|
0
|
3,81
|
|
T wrzenia [°
C]
|
100
|
101,43
|
|
Ciepło topnienia [J/mol]
|
6,022
|
6,505
|
|
Ciepło parowania [J/mol]
|
40,824
|
41,622
|
|
Stała dielektryczna
|
78,39
|
78,08
|
|
Napięcie powierzchniowe
[J/m2]
|
71,98 x 10-3
|
71,92 x 10-3
|
|
Lepkość [Pa*s]
|
0,8905 x 10-3
|
1,103 x 10-3
|
[dane zostały zaczerpnięte
z książki: A. Czerwiński, “Energia jądrowa i promieniotwórczość”, Oficyna
Edukacyjna Krzysztof Pazdro, Warszawa, 1998, str. 89
oraz z Encyklopedii WIEM portalu
Onet.pl]
Praca została napisana na podstawie:
Praca zbiorowa, “Prawie wszystko o wodzie”, Pracownia Dydaktyki Fizyki
Instytutu Fizyki Uniwersytetu Mikołaja Kopernika, Toruń, 1997
Z niej też pochodzą rysunki.
*Dominika
Zając - studentka III roku Wydziału Chemii UW rok. akad. 2001/2002
|