| Potencjometria
jest metodą wykorzystującą zależność między aktywnością oznaczanego jonu
w roztworze, a potencjałem elektrycznym elektrody. Praktycznie wyznacza
się stężenie oznaczanego składnika na podstawie SEM ogniwa utworzonego
z elektrody wzorcowej i pomiarowej (dla roztworów rozcieńczonych).
Zależność tę opisuje najogólniej równanie Nernsta |
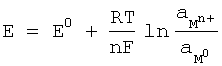 R - stała gazowa (8,31441 J K-1 mol-1) T - temperatura bezwzględna (K) F - stała Faraday’a (96486,7± 0,54 C mol-1) n - liczba elektronów biorąca udział w reakcji aMn+ - aktywność jonów metalu aM0 = 1 |
| Mierząc
stężenie jonów wodorowych wkraczamy w zakres PEHAMETRII.pH
jest ujemnym log [H+] z wartości stężenia jonów wodorowych.
Pomiaru stężenia jonów dokonuje się praktycznie np. mierząc SEM ogniwa złożonego z dwóch elektrod wchodzących w skład tzw. elektrody kombinowanej (rys). 1 - elektroda
wyprowadzająca chlorosrebrowa
|
 |