|
WYDZIAŁ
CHEMII - ZAKŁAD DYDAKTYCZNY TECHNOLOGII
CHEMICZNEJ
Ćwiczenie 19 ABSORPCYJNE ODSIARCZANIE ODLOTOWYCH GAZÓW PRZEMYSŁOWYCH Opracowała dr Jadwiga Skupińska WSTĘP Niekontrolowany rozwój przemysłu i żywiołowy postęp cywilizacji stanowi poważne zagrożenie dla naturalnego środowiska człowieka. W dniu dzisiejszym najważniejszym problemem jest ochrona środowiska. Jednym z jej aspektów jest utylizacja zanieczyszczeń gazowych emitowanych do atmosfery. Źródłem zanieczyszczeń gazowych obok zakładów przemysłowych są także samochody, kotłownie miejskie i domowe oraz duży udział mają źródła naturalne ( pożary lasów, wybuchy wulkanów, procesy gnilne itp. ). Obecnie problem ograniczenia emisji zanieczyszczeń gazowych jest realizowany dwoma sposobami:
procesy fizyczne:
oraz procesy chemiczne:
rozkład katalityczny W celu przeniesienia określonej masy zanieczyszczeń z gazu do cieczy konieczne jest przeniknięcie cząstek przez strefę przyległą do granicy faz i przez granicę faz, tj. przez powierzchnię międzyfazową. Przenoszenie cząsteczek do granicy faz zarówno w fazie gazowej, jak i ciekłej określa szybkość dyfuzji cząsteczkowej i burzliwej. Szybkość absorpcji zwiększa się przez zwiększenie powierzchni międzyfazowej oraz zwiększenie szybkości dyfuzji. Zwiększenie powierzchni międzyfazowej można osiągnąć przez rozproszenie jednej fazy w drugiej np. rozproszenie fazy gazowej w cieczy przez zastosowanie bełkotki lub mieszania. Zwiększenie etapu dyfuzji realizuje się przez odpowiednio długi czas zetknięcia faz oraz przez zwiększenie burzliwości przepływu w obu fazach np.: gwałtowne mieszanie. Podczas absorpcji może zachodzić bezprzeponowa wymiana ciepła, kondensacja oraz nawilżanie gazów. Jeżeli stężenie zanieczyszczeń jest odpowiednio duże, absorpcja stanowić może metodę odzysku wartościowych substancji. Może stanowić wstępny etap oczyszczania gazu w procesie kompleksowego oczyszczania lub końcowy, gdy absorpcja jest połączona z reakcją chemiczną. Absorpcja stosowana jest wówczas, gdy stężenie zanieczyszczeń wynosi kilka procent a w przypadku gazów rozcieńczonych, gdy są one łatwo rozpuszczalne w absorbencie. Absorbentami są: woda, roztwory kwasów, zasad, soli o właściwościach utleniających lub redukujących. Szybkość absorpcji zwiększa się wówczas, gdy zachodzi reakcja chemiczna między cieczą i gazem, przy czym wzrasta współczynnik wnikania po stronie cieczy Podczas absorpcji z reakcją chemiczną składnik A ze strumienia gazu reaguje z substancją B zawartą w cieczy, w wyniku czego powstaje produkt o właściwościach odmiennych od substancji wyjściowej. Przy oczyszczaniu gazów odlotowych absorpcja z reakcją chemiczną jest jedną z zasadniczych metod usuwania zanieczyszczeń kwaśnych, takich jak SO2, SO3, H2S, NOx, HF, C12, HCl i in. Metody absorpcyjne stosowane są często w połączeniu z utlenianiem albo z biodegradacją. W metodach absorpcyjnych połączonych z utlenianiem można stosować jako absorbenty roztwory utleniaczy takich jak chlor, dwutlenek chloru, podchloryn sodowy, nadmanganian potasu oraz obecnie najbardziej popularny ozon. Ozon rozpuszczony jest w absorbencie. Reakcja pomiędzy ozonem i zaabsorbowanym zanieczyszczeniem przebiega bardzo szybko. Jednocześnie następuje likwidacja drobnoustrojów, co często ma duże znaczenie. Zastosowanie ozonu nie powoduje powstawania kłopotliwych odpadów, ponieważ produktem jego rozpadu jest tlen. Niektóre substancje zanieczyszczające gazy odlotowe można skutecznie likwidować na drodze biodegradacji za pomocą mikroorganizmów, które utleniają związki organiczne do dwutlenku węgla i wody lub mineralizują zawarte w nich heteroatomy. Wytwarzana w tym procesie energia jest zużywana przez bakterie. Adsorpcja jest procesem, w którym cząsteczki jednej substancji zostają związane na powierzchni innej substancji, następuje sorpcja zanieczyszczeń gazowych przez stały adsorbent. Adsorpcja polega na wydzielaniu i zatrzymywaniu składników gazu na powierzchni zewnętrznej i wewnętrznej (w porach) ciała stałego. Zatrzymywanie cząsteczek na powierzchni zachodzi w wyniku dziabania sił fizycznych i chemicznych bliskiego zasięgu. Energia wiązania adsorbowanych cząsteczek z powierzchną jest porównywalna z ciepłem kondensacji. Proces adsorpcji jest egzotermiczny. Proces odwrotny, usuwanie cząsteczek zaadsorbowanych z powierzchni do przestrzeni otaczającego płynu zwany desorpcją wymaga więc doprowadzenia ciepła. Liczba cząsteczek możliwa do zaadsorbowania na powierzchni adsorbentu jest ograniczona i maleje ze wzrostem temperatury. Efektywnej adsorpcji sprzyjać więc będzie duża powierzchnia właściwa adsorbentu i niska temperatura. Adsorpcja jest selektywna i największą zdolność do adsorpcji wykazują cząsteczki gazów o dużej masie i niskiej temperaturze wrzenia. Ulegając adsorpcji, wypierają przy tym inne cząsteczki o mniejszej energii wiązania. Niektóre procesy adsorpcji są nieodwracalne, np. chemisorpcja, dla której energia wiązania cząsteczek na powierzchni jest tu tak duża, że zaadsorbowana substancja może być zdesorbowana tylko w postaci związku chemicznego lub usunięta jak substancja stała. Adsorpcja umożliwia oczyszczanie dużych strumieni gazów o małym stężeniu zanieczyszczeń do poziomu ppm. Podczas adsorpcyjnego oczyszczania gazów zanieczyszczenia o małym stężeniu, 20-30 ppm, są zatężane, co w dalszym etapie umożliwia ich spalenie lub ekonomiczne wykorzystanie. Ponadto tą metodą można jednocześnie usuwać z gazu więcej zanieczyszczeń, zwłaszcza substancje organiczne. Kondensacja jest metodą usuwania z gazów odlotowych substancji o niskim ciśnieniu par w umiarkowanie podwyższonych temperaturach lub o wysokim ciśnieniu par, gdy nie jest wymagane bardzo dokładne oczyszczanie gazu do stężeń kilku ppm. Konieczność wymrażania gazu w końcowym etapie oczyszczania tą metodą ogranicza jej zastosowanie. Spalanie bezpośrednie (termiczne lub katalityczne ) stosowane jest do usuwania z gazów odlotowych węglowodorów poprzez ich utlenienie do CO2 i H2O. W przypadku niskich stężeń węglowodorów
w gazach odlotowych stosuje się spalanie katalityczne.
Katalizator definiuje się więc jako substancję, która zwiększa szybkość z jaką reakcja chemiczna osiąga stan równowagi, sama się jednak nie zużywa i której symbol nie występuje w równaniu stechiometrycznym. Wpływ katalizatora na reakcję chemiczną polega głównie na obniżeniu jej energii aktywacji. Potwierdza to wiele faktów doświadczalnych. Tłumaczy się to tworzeniem przejściowych aktywnych kompleksów katalizatora z substratami, po rozpadzie których katalizator ulega regeneracji. W procesie spalania katalitycznego strumień gazu przepuszcza się przez ziarno katalizatora w podwyższonej temperaturze. Katalityczne spalanie węglowodorów przebiega w temperaturach znacznie niższych niż spalanie termiczne ok. 250oC. Jako katalizatory spalania węglowodorów stosowane są metale jak: platyna, pallad, ruten, rod lub tlenki metali przejściowych jak: tlenek manganu, chromu, miedzi. Katalizatory stosuje się naniesione na nośniki ceramiczne tzw. adsorbenty. Nośniki charakteryzują się bardzo rozwiniętą powierzchnią wewnętrzną ( kanaliki), mają często kształt plastra miodu. Redukcja katalityczna stosowana w procesach usuwania tlenków azotu z gazów odlotowych polega na redukcji tlenków azotu za pomocą amoniaku, tlenku węgla lub węglowodorów w obecności katalizatorów.
Katalizatorami tej reakcji są metale szlachetne jak platyna, pallad, rod naniesione na ceramiczne nośniki. Platyna na nośniku ceramicznym jest katalizatorem stosowanym w samochodach dla dopalania spalin i jednoczesnej redukcji tlenków azotu. Rozkład katalityczny tlenków azotu jest prostą metodą usuwania ich ze strumienia gazów przemysłowych.
Na dzień dzisiejszy jest to metoda szeroko badana w laboratoriach i wiąże się z nią duże nadzieje aplikacyjne ponieważ nie wymaga dodawania do strumienia gazu żadnych reagentów i produktami są tylko azot i tlen. Najlepszymi katalizatorami tej reakcji są zeolity modyfikowane jonami miedzi. Zeolity to są krystaliczne glinokrzemiany naturalne i sztuczne o wzorze ogólnym: M2/nO. Al2O3. xSiO2. yH2O gdzie x > 2, n = wartościowość kationu metalu M. Maksymalna wartość x dla naturalnych zeolitów jest równa 10. Mają one bardzo dużą powierzchnię wewnętrzną w postaci kanalików o określonej geometrii.
Metody usuwania ditlenku siarki z gazów przemysłowych Zmniejszenie emisji związków siarki do atmosfery, głównie SO2, powstających w procesach przemysłowych jest w chwili obecnej jednym z najważniejszych zagadnień ochrony środowiska. Ditlenek siarki jest jednym z najbardziej niebezpiecznych zanieczyszczeń powietrza atmosferycznego i wiele danych wskazuje na prostą zależność pomiędzy stopniem zanieczyszczenia powietrza ditlenkiem siarki a stanem zdrowia ludności narażonej na jego oddziaływanie. Obok SO2 w skład zanieczyszczeń siarkowych gazów odlotowych w wielu przypadkach wchodzi również SO3 i H2S; SO3 powstaje podczas spalania paliw obok SO2 i stanowi 1-10% jego stężenia. W powietrzu SO3 ulega bardzo szybko reakcji z parą wodną z utworzeniem H2SO4. Siarkowodór H2S jest gazem bezbarwnym i palnym o dużej toksyczności, charakteryzującym się przy tym bardzo nieprzyjemnym odorem zgniłych jaj. Bardzo łatwo utlenia się do SO2 i w procesach oczyszczania gazów jest źródłem SO2, H2SO4 lub siarki elementarnej Oprócz wymienionych związków w gazach odlotowych emitowanych z różnych źródeł znajdują się związki siarki w postaci zredukowanej CS, COS, CS2 oraz organiczne, jak np.: RSH, RSR, RS2R. Organiczne, odorowe związki siarki są wydzielane z gazów zwykle metodami adsorpcji i spalania. Jak wiadomo, najpoważniejszymi źródłami emisji SO2 są zakłady energetyczne i ciepłownicze, metalurgiczne oraz przemysłu chemicznego. Paliwa ciekłe i gazowe są oczyszczane przed ich spalaniem Zasadniczy udział w emisji SO2 ma spalanie różnych gatunków węgla, stąd większość metod odsiarczania jest związana z procesami przetwarzania węgla. Siarkę można usuwać na etapie przygotowania węgla do spalania, podczas spalania lub ze spalin odlotowych. Radykalnym rozwiązaniem byłoby odsiarczanie węgla, lecz obecnie ze względów ekonomicznych i jest to mało konkurencyjna metoda w stosunku do innych metod stosowanych do odsiarczania. Spośród metod odsiarczania podczas spalania największe nadzieje rokuje odsiarczanie w paleniskach fluidyzacyjnych. Odsiarczanie spalin odlotowych ma najdłuższą, tradycję i znajduje najszersze zastosowanie. Liczba proponowanych metod jest tu znaczna i cięg1e wzrasta. Metody te są oparte na procesach podstawowych jak absorpcja lub adsorpcja, połączonych często z reakcją chemiczną. Odsiarczanie w procesie spalania Usuwanie siarki podczas spalania paliwa jest związane zasadniczo ze spalaniem węgla w kotłach energetyczno-ciepłowniczych, przeznaczenia ogólnego i przemysłowego. Klasyczna techniką spalana paliw stałych
jest spalanie w warstwie lub zawiesinie pyłu (fluidalnej). Paleniska fluidyzacyjne
ciągle udoskonalane, oprócz dobrych warunków spalania, zapewniają również
możliwość jednoczesnego usuwania SO2 i NOx, zmniejszenie
emisji z paleniska związków Na i K, a tym samym odkładania się ich
na powierzchniach wymiany ciepła. Podczas spalania siarka z węgla jest
szybko utleniana do SO2, szybciej niż C do CO2. Możliwych
produktów utleniania siarki w warunkach spalania jest więcej, lecz najbardziej
stabilne są SO2 i SO3. Procesy tworzenia SO2
i SO3 są egzotermiczne.
Szybkość utleniania do SO3 jest mniejsza i zwiększa się w wyższych temperaturach. Równowaga w procesie spalania jest przesunięta w kierunku tworzenia SO2, a konwersja SO2 do SO3 w niższych temperaturach spalin jest bardzo wolna. Dlatego też spaliny oczyszcza się z SO2 a nie SO3, którego stężenie jest bardzo małe. Około 5-15% siarki reaguje nieodwracalnie z naturalnymi alkalicznymi związkami węgla i przechodzi do popiołu. W celu zwiększenia stopnia odsiarczania powstała koncepcja iniekcji do paleniska dodatkowej masy substancji alkalicznych lub prowadzenia procesu spalania w złożu fluidalnym z dodatkiem sorbentu: wapienia lub dolomitu. Sorbent jest wprowadzany do strefy spalania ponad palnikami pyłowymi. Po zmieszaniu ze spalinami, w wysokiej
temperaturze strefy spalania przebiega proces kalcynacji rozdrobnionego
wapienia, którego główny składnik – węglan wapnia ulega rozkładowi
do tlenku wapnia ( tzw. wapno palone) zgodnie z reakcją nr 3.
Najkorzystniejsze są cząstki wapniaka o jak najmniejszych rozmiarach, lecz ograniczenia praktyczne powodują, że przy stosowanych rozmiarach cząstek wykorzystanie wapienia nie jest duże. Powstający na powierzchni cząstek wg reakcji (4) CaSO4 blokuje dostęp do wnętrza i zmniejsza aktywność chemiczną. Jest to jednym z zasadniczych powodów malej sprawności odsiarczania spalin i wykorzystania wapienia. Dlatego też metoda iniekcji wapienia do paleniska nie znalazła szerszego zastosowania w dużych jednostkach energetycznych. Ponadto, jak wiadomo, zasadniczym celem procesu spalania w kotłach jest uzyskanie maksimum energii, a nie maksymalne usunięcie SO2 ze spalin. Biorąc pod uwagę właściwości alkaliczne niektórych popiołów, w których zawartość (CaO+ MgO) może być większa od 20% mas., są prowadzone próby wykorzystania ich jako czynnika wiążącego. Odsiarczanie gazów odlotowych Odsiarczanie gazów odlotowych w największym stopniu jest związane z oczyszczaniem spalin z elektrociepłowni i elektrowni oraz gazów odlotowych z przeróbki ropy naftowej, wytopu i przeróbki metali, produkcji kwasu siarkowego. Proponowanych jest wiele metod odsiarczania, lecz tylko nieliczne jak dotąd znalazły zastosowanie praktyczne w wymienionych gałęziach przemysłu. Wynika to z trudności technicznych, ekonomiki, a także z rozbieżności w efektywności procesu odsiarczania przy przejściu na dużąskalę. Duże objętości strumieni spalin do oczyszczania, ponad 100 tys. ton dziennie lub ok. 5 mln m3/h w jednostkach energetycznych rzędu 1000 MW, stwarzają całkiem nową skalę w projektowaniu procesu. Dodatkową trudnością jest zmienny strumień i skład spalin odbiegający od ustalonego, z którym ma się do czynienia zwykle w przemyśle chemicznym. Metody odsiarczania dzieli się na:
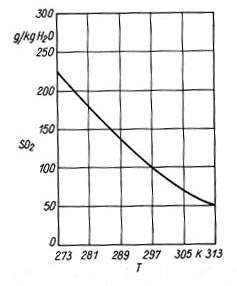
Zarówno procesy regeneracyjne, jak i nieregeneracyjne odsiarczania mogą być prowadzone jako mokre lub suche, przy czym określenie takie może się odnosić do stanu produktu końcowego, stosowania cieczy lub nie oraz do nawilżania i chłodzenia oczyszczonych gazów. Metody mokre Metoda wapniowo-wapienna Metoda wapniowo-wapienna jest procesem nieregeneracyjnym z punktu widzenia odzysku siarki oraz roztworu reakcyjnego. Metoda oparta jest na absorpcji i reakcji chemicznej SO2 w zawiesinie wapna( CaO ) lub kamienia wapiennego ( CaCO3 ). Powstające w wyniku reakcji CaSO3 i CaSO4 w postaci szlamu lub wilgotnego ciała stałego w większości przypadków stanowią odpad. Podczas absorpcji SO2 w zawiesinie wodnej w pierwszym etapie zachodzą procesy 1) 2) 3) Rozpuszczalność SO2 w wodzie (rys. 1) jest funkcją temperatury i maleje z jej wzrostem. W praktyce ciecz nie stanowi czystej wody, lecz roztwór zawierający szereg rozpuszczonych soli, w tym głównie chlorkowych, w wyniku czego szybkość absorpcji ulega zwiększeniu. W przypadku gdy w roztworze absorpcyjnym znajduje się wapno CaO, podczas absorpcji zachodzić będą reakcje 4) 5) 6) 7)
W obecności tlenu jon siarczynowy może ulec utlenieniu zgodnie z reakcjami 8) 9)
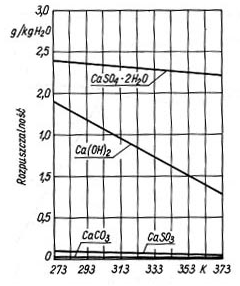
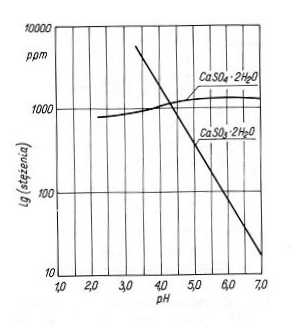
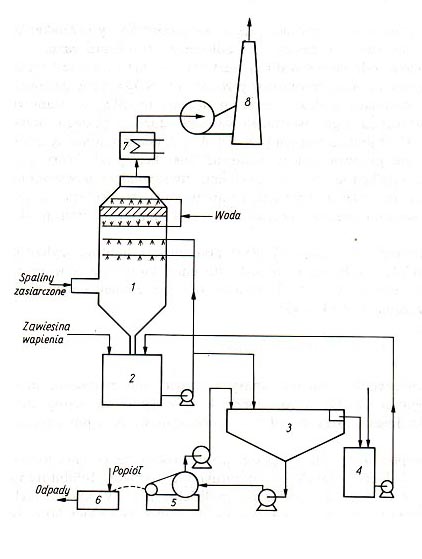
zależy od stężenia jonów H+ i koncentracji CaCO3. Proces absorpcji SO2 powinien być więc prowadzony w zawiesinie wapna przy pH ok. 8, w zawiesinie kamienia wapiennego przy pH ok. 6. Różnice pH w stosunku do wartości optymalnych są powodem tworzenia się twardego CaSO4 przy małym pH, który osiadając na ściankach powoduje blokowanie wnętrza aparatury. Szybkość tworzenia się siarczanu wg reakcji (7) i (8) przy małym pH jest większa, gdyż wzrasta rozpuszczalność siarczynu. Przy dużym pH powstaje osad stosunkowo miękki CaSO3, który blokuje przeloty przewodów. Rozpuszczalność CaSO3 i CaSO4 w zależności od pH przedstawiono na rys.3. W praktyce przebieg procesów chemicznych odsiarczania ze względu na obecność w układzie wielu soli, m.in. takich kationów jak Na, K, Mg, Fe, Al itd., jest bardziej skomplikowany, niż wynika to z przedstawionych powyżej reakcji. W procesie absorpcji zasadniczym zagadnieniem jest kontrola pH. W celu ograniczenia wahań pH ze zmianą stężenia SO2 w gazach odlotowych i tym samym zmniejszenia możliwości blokowania wnętrza aparatury procesowej oraz zwiększenia sprawności odsiarczania do roztworu absorpcyjnego wprowadza się różne dodatki. Jako dodatki stosowane są np. kwas adypinowy, benzoesowy, mrówkowy, węglany, tiosiarczan sodu. Schemat typowej instalacji do prowadzenia odsiarczania metodą wapniowo-wapienną przedstawiono na rys. 4.
W skład instalacji wchodzą układy: absorpcyjny – skruber, przygotowania i transportu zawiesiny Ca(OH)2 lub CaCO3, podgrzewania spalin oczyszczonych oraz utleniania, krystalizacji i rozdziału zawiesiny poreakcyjnej. Odsiarczanie jest prowadzone w skruberze do którego mogą być kierowane gazy już odpylone i ochłodzone, bądź odpylanie, chłodzenie i absorpcja są prowadzone jednocześnie w jednym aparacie. W tym ostatnim przypadku projektuje się specjalne rozwiązanie, szczególnie dołu aparatu, by zapobiec blokowaniu pomp cyrkulacyjnych, przewodów i dysz osadem i oddzielić strefę absorpcji od strefy wydzielania ciała stałego. Produktem jest gips, który może być otrzymywany w postaci płyt lub proszku. Metoda magnezowa (regeneracyjna) Ditlenek siarki absorbowany jest w wodnym roztworze soli magnezu. Produktem jest mieszanina siarczynów i siarczanów magnezu. Po wysuszeniu mieszanina jest poddawana kalcynacji w wyniku odzyskuje się tlenek magnezu i dwutlenek siarki kierowany do produkcji kwasu siarkowego. Metody rozwojowe. Jak wiadomo, w procesach absorpcji SO2 dominują roztwory wodne. Przez dodatek do wody różnego rodzaju substancji można zmienić warunki równowagi na granicy faz gaz-ciecz oraz w głębi roztworu i spowodować wzrost wydajności absorpcji nawet o kilka rzędów wielkości. Efektywną metodą usuwania SO2 z odpylonych gazów jest absorpcja SO2 w kolumnie z wypełnieniem zraszanym wodą utlenionę (opracowaną przez firmę Degussa, RFN). Metoda ta umożliwia zmniejszenie stężenia SO2 w gazach odlotowych do atmosfery do ok. 20 mg/Nm3. Produktem odsiarczania jest 70-proc. H2SO4. W procesach metalurgicznych do odsiarczania stężonych gazów odlotowych (do 5% SO2) Są stosowane metody oparte na absorpcji SO2 w roztworach amin. Metody te umożliwiają uzyskanie hSO2 > 99%, lecz są nieekonomiczne w przypadku odsiarczania gazów rozcieńczonych z elektrociepłowni. Trwają również badania nad procesem biologicznej redukcji SO2 jako metody regeneracyjnej usuwania SO2 ze spalin odlotowych. Metody suche Metody suche odsiarczania charakteryzują się tym, że procesy wiązania chemicznego SO2 przebiegają w stanie suchym, tj. w układzie gaz-ciało stałe, lub produkty odsiarczania użytkowe lub odpadowe są utylizowane w stanie suchym. Dlatego też unika się kłopotów związanych z osadzaniem się w aparatach ciał stałych, kontrolą pH, podgrzewaniem gazów oczyszczonych oraz gromadzeniem ciekłych odpadów. Metody suche odsiarczania oparte są przede wszystkim na adsorpcji na sorbentach stałych takich jak tlenki metali lub węgiel aktywowany oraz absorpcji z reakcją chemiczną z jednoczesnym suszeniem produktów odsiarczania. W badaniach są procesy wiązania SO2 oparte na reakcji chemicznej w fazie gazowej z substancjami alkalicznymi stałymi lub gazowymi. W przypadkach stosowania węgli wysokoaktywnych w ich porach powstaje H2SO4 i usunięcie jego stanowi problem, który może być rozwiązany metodą Sulfacid, przez ogrzewanie warstwy w celu zainicjowania reakcji pomiędzy węglem a H2SO4 i wytwarzaniem stężonego SO2 do produkcji H2SO4 lub siarki elementarnej przez redukcję odpowiednim gazem. Wymienione metody, z wyjątkiem Sulfacid, nie są jak dotąd wykorzystywane w większej skali. Porównanie metod mokrych i suchych Porównanie mokrych i suchych metod odsiarczania dotyczyć może m. in. zapotrzebowania reagentów i energii, gromadzenia i neutralizacji odpadów, eksploatacji i obsługi oraz ekonomiki procesu. Zasadniczy etap odsiarczania metodami mokrymi przebiega w skruberze przed skierowaniem gazów do komina. W wyniku kontaktu z wodą lub z roztworem następuje schłodzenie gazów do temperatury ok. 320 K, co jest temperaturą niższą od tzw. normalnej temperatury kominowej, ok.420 K. Stanowi to poważna wadę metod mokrych oprócz konieczności stosowania specjalnych materiałów konstrukcyjnych w strefie mokrej instalacji. Gazy oczyszczone przed skierowaniem do komina muszą być podgrzewane. W metodach mokrych przenoszenie masy do czynnej powierzchni ciekłego reagenta jest zdecydowanie lepsze, niszczenie absorbentu nie stanowi problemu. Możliwe komplikacje wynikać mogą z reakcji ubocznych i odwrotnych. Usuwanie wody z produktu jest kosztowne. Metody suche przy osiąganiu tej samej sprawności wymagają nieco większego stosunku stechiometrycznego sorbentu do SO2. Wielkość ta jest minimalizowana poprzez recyrkulację produktów odsiarczania z pozostałością niewykorzystanego sorbentu w przypadku metod odpadowych. Stosowane w metodach suchych sorbenty są jednak bardziej kosztowne, lecz zużycie wody jest o ok. 50% mniejsze lub woda nie jest stosowana. W większości procesów odsiarczania koszt reagentów ocenia się na 25-35% kosztów eksploatacji. Koszty te mogę być zmniejszone, gdy istnieją możliwości wykorzystania odpadowych cieczy alkalicznych (m. in. w przemyśle metalowym, tekstylnym, papierniczym). Zapotrzebowanie energii w metodach suchych jest mniejsze w wyniku wyeliminowania operacji z bardzo dużymi objętościami strumieni zawiesin oraz podgrzewania oczyszczonych gazów. W metodzie wapniowo-wapiennej wymienione operacje zużywają 6o-75% całości doprowadzonej energii. W przypadku gdy odsiarczanie jest procesem odpadowym, metody suche umożliwiają lepsze wykorzystanie istniejących środków transportu i stwarzają mniej problemów z gromadzeniem odpadów. Produkty odsiarczania (z wyjątkiem soli sodowych) są praktycznie nierozpuszczalne, łatwe do przetworzenia na niepalący granulat o różnym zastosowaniu. Ze względu na wyeliminowanie w metodach suchych wielu węzłów aparatów koniecznych w metodach mokrych oraz brak blokowania wnętrza aparatury osadami, a także ograniczenie korozji, potrzebna jest mniejsza jest liczba aparatów w instalacji co ułatwia eksploatację przy zmniejszonej obsłudze. Zmniejsza to koszty inwestycyjne i eksploatacyjne. Metody suche odpadowe są o ok. 30-40% tańsze od metod mokrych w porównywalnych warunkach. Stąd metody suche odpadowe są preferowane w procesach oczyszczania gazów z mniejszych źródeł emisji, szczególnie z odpylaniem końcowym w filtrach tkaninowych i granulowaniem produktów oczyszczania. Do wad metod suchych odsiarczania stosujących stałe sorbenty zalicza się małą efektywność wykorzystania ziaren sorbentu, małą prędkość gazu, duże straty sorbentu podczas regeneracji. Ekonomika odsiarczania ze względu na wysoki koszt istniejących technologii odsiarczania jest czynnikiem krytycznym dla jej stosowania szczególnie w krajach pozornie oszczędzających i przyspieszających rozwój kosztem ochrony środowiska. Metody regeneracyjne odsiarczania są na ogół bardziej kosztowne niż odpadowe. Ich koszt inwestycyjny jest o 15 -40% większy, a eksploatacyjny do 60% w stosunku do metod mokrych odpadowych. Różnice te maleją ze wzrostem mocy siłowni w większym stopniu dla kosztów inwestycyjnych .niż eksploatacyjnych Powyższy tekst przygotowano w oparciu o fragmenty książek: J.Warych, “Oczyszczanie przemysłowych gazów odlotowych” PWN, 1994. Pr. zbiorowa pod redakcja J.Adamca, “Ćwiczenia z chemii i technologii oczyszczania gazów”.
Instrukcja wykonania ćwiczenia Celem ćwiczenia jest zapoznanie z absorpcyjną
metodą usuwania SO2 z gazów. W ćwiczeniu
Opis ćwiczenia. Schemat aparatury
Wymagania:
Proponowana literatura uzupełniająca:
|