|
WYDZIAŁ
CHEMII - ZAKŁAD DYDAKTYCZNY TECHNOLOGII
CHEMICZNEJ
Ćwiczenie 19 ABSORPCYJNE ODSIARCZANIE ODLOTOWYCH GAZÓW PRZEMYSŁOWYCH Opracowała dr Jadwiga Skupińska
WSTĘP Niekontrolowany rozwój przemysłu i żywiołowy postęp cywilizacji stanowi poważne zagrożenie dla naturalnego środowiska człowieka. W dniu dzisiejszym najważniejszym problemem jest ochrona środowiska. Jednym z jej aspektów jest utylizacja zanieczyszczeń gazowych emitowanych do atmosfery. Źródłem zanieczyszczeń gazowych obok zakładów przemysłowych są także samochody, kotłownie miejskie i domowe oraz duży udział mają źródła naturalne ( pożary lasów, wybuchy wulkanów, procesy gnilne itp. ). Obecnie problem ograniczenia emisji zanieczyszczeń gazowych jest realizowany dwoma sposobami:
Ze względu na dużą różnorodność źródeł emisji zanieczyszczeń gazowych różne są właściwości fizykochemiczne zanieczyszczonych strumieni gazu, różne stężenie zanieczyszczeń, różne warunki występowania stanu równowagi oraz różny poziom dopuszczalnej emisji do atmosfery. Do oczyszczania gazów z zanieczyszczeń gazowych wykorzystuje się prawie wszystkie podstawowe procesy wymiany masy, procesy fizyczne:
oraz procesy chemiczne:
W celu przeniesienia określonej masy zanieczyszczeń
z gazu do cieczy konieczne jest przeniknięcie cząstek przez strefę przyległą
do granicy faz i przez granicę faz, tj. przez powierzchnię międzyfazową.
Przenoszenie cząsteczek do granicy faz zarówno w fazie gazowej, jak i ciekłej
określa szybkość dyfuzji cząsteczkowej i burzliwej. Szybkość absorpcji
zwiększa się przez zwiększenie powierzchni międzyfazowej oraz zwiększenie
szybkości dyfuzji. Zwiększenie powierzchni międzyfazowej można osiągnąć
przez rozproszenie jednej fazy w drugiej np. rozproszenie fazy gazowej
w cieczy przez zastosowanie bełkotki lub mieszania. Zwiększenie etapu dyfuzji
realizuje się przez odpowiednio długi czas zetknięcia faz oraz przez zwiększenie
burzliwości przepływu w obu fazach np.: gwałtowne mieszanie.
Podczas absorpcji może zachodzić bezprzeponowa
wymiana ciepła, kondensacja oraz nawilżanie gazów. Jeżeli stężenie zanieczyszczeń
jest odpowiednio duże, absorpcja stanowić może metodę odzysku wartościowych
substancji. Może stanowić wstępny etap oczyszczania gazu w procesie kompleksowego
oczyszczania lub końcowy, gdy absorpcja jest połączona z reakcją chemiczną.
Absorpcja stosowana jest wówczas, gdy stężenie
zanieczyszczeń wynosi kilka procent a w przypadku gazów rozcieńczonych,
gdy są one łatwo rozpuszczalne w absorbencie. Absorbentami są: woda, roztwory
kwasów, zasad, soli o właściwościach utleniających lub redukujących. Szybkość
absorpcji zwiększa się wówczas, gdy zachodzi reakcja chemiczna między cieczą
i gazem, przy czym wzrasta współczynnik wnikania po stronie cieczy Podczas
absorpcji z reakcją chemiczną składnik A ze strumienia gazu reaguje z substancją
B zawartą w cieczy, w wyniku czego powstaje produkt o właściwościach odmiennych
od substancji wyjściowej. Przy oczyszczaniu gazów odlotowych absorpcja
z reakcją chemiczną jest jedną z zasadniczych metod usuwania zanieczyszczeń
kwaśnych, takich jak SO2, SO3, H2S, NOx,
HF, C12, HCl i in.
Metody absorpcyjne stosowane są często
w połączeniu z utlenianiem albo z biodegradacją.
W metodach absorpcyjnych połączonych z
utlenianiem można stosować jako absorbenty roztwory utleniaczy takich jak
chlor, dwutlenek chloru, podchloryn sodowy, nadmanganian potasu oraz obecnie
najbardziej popularny ozon. Ozon rozpuszczony jest w absorbencie. Reakcja
pomiędzy ozonem i zaabsorbowanym zanieczyszczeniem przebiega bardzo szybko.
Jednocześnie następuje likwidacja drobnoustrojów, co często ma duże znaczenie.
Zastosowanie ozonu nie powoduje powstawania kłopotliwych odpadów, ponieważ
produktem jego rozpadu jest tlen.
Niektóre substancje zanieczyszczające gazy
odlotowe można skutecznie likwidować na drodze biodegradacji za pomocą
mikroorganizmów, które utleniają związki organiczne do dwutlenku węgla
i wody lub mineralizują zawarte w nich heteroatomy. Wytwarzana w tym procesie
energia jest zużywana przez bakterie.
Adsorpcja jest procesem, w którym
cząsteczki jednej substancji zostają związane na powierzchni innej substancji,
następuje sorpcja zanieczyszczeń gazowych przez stały adsorbent.
Adsorpcja polega na wydzielaniu i zatrzymywaniu składników gazu na powierzchni
zewnętrznej i wewnętrznej (w porach) ciała stałego. Zatrzymywanie cząsteczek
na powierzchni zachodzi w wyniku dziabania sił fizycznych i chemicznych
bliskiego zasięgu. Energia wiązania adsorbowanych cząsteczek z powierzchną
jest porównywalna z ciepłem kondensacji. Proces adsorpcji jest egzotermiczny.
Proces odwrotny, usuwanie cząsteczek zaadsorbowanych z powierzchni do przestrzeni
otaczającego płynu zwany desorpcją wymaga więc doprowadzenia ciepła.
Liczba cząsteczek możliwa do zaadsorbowania na powierzchni adsorbentu jest
ograniczona i maleje ze wzrostem temperatury. Efektywnej adsorpcji sprzyjać
więc będzie duża powierzchnia właściwa adsorbentu i niska temperatura.
Adsorpcja jest selektywna i największą zdolność do adsorpcji
wykazują cząsteczki gazów o dużej masie i niskiej temperaturze wrzenia.
Ulegając adsorpcji, wypierają przy tym inne cząsteczki o mniejszej energii
wiązania.
Niektóre procesy adsorpcji są nieodwracalne,
np. chemisorpcja, dla której energia wiązania cząsteczek na powierzchni
jest tu tak duża, że zaadsorbowana substancja może być zdesorbowana tylko
w postaci związku chemicznego lub usunięta jak substancja stała.
Adsorpcja umożliwia oczyszczanie dużych
strumieni gazów o małym stężeniu zanieczyszczeń do poziomu ppm. Podczas
adsorpcyjnego oczyszczania gazów zanieczyszczenia o małym stężeniu, 20-30
ppm, są zatężane, co w dalszym etapie umożliwia ich spalenie lub ekonomiczne
wykorzystanie. Ponadto tą metodą można jednocześnie usuwać z gazu więcej
zanieczyszczeń, zwłaszcza substancje organiczne.
Kondensacja jest metodą usuwania
z gazów odlotowych substancji o niskim ciśnieniu par w umiarkowanie podwyższonych
temperaturach lub o wysokim ciśnieniu par, gdy nie jest wymagane bardzo
dokładne oczyszczanie gazu do stężeń kilku ppm. Konieczność wymrażania
gazu w końcowym etapie oczyszczania tą metodą ogranicza jej zastosowanie.
Spalanie bezpośrednie (termiczne
lub katalityczne ) stosowane jest do usuwania z gazów odlotowych węglowodorów
poprzez ich utlenienie do CO2 i H2O.
W przypadku niskich stężeń węglowodorów
w gazach odlotowych stosuje się spalanie katalityczne.
Katalizator definiuje się więc jako substancję, która zwiększa szybkość z jaką reakcja chemiczna osiąga stan równowagi, sama się jednak nie zużywa i której symbol nie występuje w równaniu stechiometrycznym. Wpływ katalizatora na reakcję chemiczną polega głównie na obniżeniu jej energii aktywacji. Potwierdza to wiele faktów doświadczalnych. Tłumaczy się to tworzeniem przejściowych aktywnych kompleksów katalizatora z substratami, po rozpadzie których katalizator ulega regeneracji. W procesie spalania katalitycznego strumień gazu przepuszcza się przez ziarno katalizatora w podwyższonej temperaturze. Katalityczne spalanie węglowodorów przebiega w temperaturach znacznie niższych niż spalanie termiczne ok. 250oC. Jako katalizatory spalania węglowodorów stosowane są metale jak: platyna, pallad, ruten, rod lub tlenki metali przejściowych jak: tlenek manganu, chromu, miedzi. Katalizatory stosuje się naniesione na nośniki ceramiczne tzw. adsorbenty. Nośniki charakteryzują się bardzo rozwiniętą powierzchnią wewnętrzną ( kanaliki), mają często kształt plastra miodu. Redukcja katalityczna stosowana w procesach usuwania tlenków azotu z gazów odlotowych polega na redukcji tlenków azotu za pomocą amoniaku, tlenku węgla lub węglowodorów w obecności katalizatorów.
Katalizatorami tej reakcji są metale szlachetne jak platyna, pallad, rod naniesione na ceramiczne nośniki. Platyna na nośniku ceramicznym jest katalizatorem stosowanym w samochodach dla dopalania spalin i jednoczesnej redukcji tlenków azotu. Rozkład katalityczny tlenków azotu jest prostą metodą usuwania ich ze strumienia gazów przemysłowych.
Na dzień dzisiejszy jest to metoda szeroko badana w laboratoriach i wiąże się z nią duże nadzieje aplikacyjne ponieważ nie wymaga dodawania do strumienia gazu żadnych reagentów i produktami są tylko azot i tlen. Najlepszymi katalizatorami tej reakcji są zeolity modyfikowane jonami miedzi. Zeolity to są krystaliczne glinokrzemiany naturalne i sztuczne o wzorze ogólnym: M2/nO. Al2O3. xSiO2. yH2O gdzie x > 2, n = wartościowość kationu metalu M. Maksymalna wartość x dla naturalnych zeolitów jest równa 10. Mają one bardzo dużą powierzchnię wewnętrzną w postaci kanalików o określonej geometrii.
Metody usuwania ditlenku siarki z gazów przemysłowych Ditlenek siarki jest jednym z najbardziej niebezpiecznych zanieczyszczeń powietrza atmosferycznego. Stwierdzono jego negatywny wpływ na zdrowie ludności narażonej na jego oddziaływanie. Obok ditlenku siarki w skład zanieczyszczeń siarkowych gazów odlotowych w wielu przypadkach wchodzi również tritlenek siarki. Tritlenek siarki powstaje podczas spalania paliw obok ditlenku siarki i ulega bardzo szybko reakcji z parą wodną z utworzeniem kwasu siarkowego. Oprócz tych ·związków w gazach odlotowych emitowanych z różnych źródeł znajdują się związki siarki w postaci zredukowanej siarczek węgla, disiarczek węgla oraz organiczne, jak np.: siarkowodór, siarczki organiczne i merkamptany. Organiczne, odorowe związki siarki są wydzielane z gazów zwykle metodami adsorpcji i spalania.
Odsiarczanie w procesie spalania
Usuwanie siarki podczas spalania paliwa
jest związane zasadniczo ze spalaniem węgla w kotłach energetyczno-ciepłowniczych,
przeznaczenia ogólnego i przemysłowego.
Klasyczna techniką spalana paliw stałych
jest spalanie w warstwie lub zawiesinie pyłu (fluidalnej). Paleniska fluidyzacyjne
ciągle udoskonalane, oprócz dobrych warunków spalania, zapewniają również
możliwość jednoczesnego usuwania SO2 i NOx, zmniejszenie
emisji z paleniska związków Na i K, a tym samym odkładania się ich
na powierzchniach wymiany ciepła. Podczas spalania siarka z węgla jest
szybko utleniana do SO2, szybciej niż C do CO2. Możliwych
produktów utleniania siarki w warunkach spalania jest więcej, lecz najbardziej
stabilne są SO2 i SO3. Procesy tworzenia SO2
i SO3 są egzotermiczne.
Szybkość utleniania do SO3 jest
mniejsza i zwiększa się w wyższych temperaturach. Równowaga w procesie
spalania jest przesunięta w kierunku tworzenia SO2, a konwersja
SO2 do SO3 w niższych temperaturach spalin jest bardzo
wolna. Dlatego też spaliny oczyszcza się z SO2 a
nie SO3, którego stężenie jest bardzo małe. Około 5-15% siarki
reaguje nieodwracalnie z naturalnymi alkalicznymi związkami węgla i przechodzi
do popiołu. W celu zwiększenia stopnia odsiarczania powstała koncepcja
iniekcji do paleniska dodatkowej masy substancji alkalicznych lub prowadzenia
procesu spalania w złożu fluidalnym z dodatkiem sorbentu: wapienia lub
dolomitu. Sorbent jest wprowadzany do strefy spalania ponad palnikami pyłowymi.
Po zmieszaniu ze spalinami, w wysokiej
temperaturze strefy spalania przebiega proces kalcynacji rozdrobnionego
wapienia, którego główny składnik – węglan wapnia ulega rozkładowi
do tlenku wapnia ( tzw. wapno palone) zgodnie z reakcją nr 3.
Najkorzystniejsze są cząstki wapniaka o
jak najmniejszych rozmiarach, lecz ograniczenia praktyczne powodują, że
przy stosowanych rozmiarach cząstek wykorzystanie wapienia nie jest duże.
Powstający na powierzchni cząstek wg reakcji (4) CaSO4 blokuje
dostęp do wnętrza i zmniejsza aktywność chemiczną. Jest to jednym z zasadniczych
powodów malej sprawności odsiarczania spalin i wykorzystania wapienia.
Dlatego też metoda iniekcji wapienia do paleniska nie znalazła szerszego
zastosowania w dużych jednostkach energetycznych. Ponadto, jak wiadomo,
zasadniczym celem procesu spalania w kotłach jest uzyskanie maksimum energii,
a nie maksymalne usunięcie SO2 ze spalin.
Biorąc pod uwagę właściwości alkaliczne
niektórych popiołów, w których zawartość (CaO+ MgO) może być większa od
20% mas., są prowadzone próby wykorzystania ich jako czynnika wiążącego.
Odsiarczanie gazów odlotowych
Odsiarczanie gazów odlotowych w największym
stopniu jest związane z oczyszczaniem spalin z elektrociepłowni i elektrowni
oraz gazów odlotowych z przeróbki ropy naftowej, wytopu i przeróbki metali,
produkcji kwasu siarkowego. Proponowanych jest wiele metod odsiarczania,
lecz tylko nieliczne jak dotąd znalazły zastosowanie praktyczne w wymienionych
gałęziach przemysłu. Wynika to z trudności technicznych, ekonomiki, a także
z rozbieżności w efektywności procesu odsiarczania przy przejściu na dużąskalę.
Duże objętości strumieni spalin do oczyszczania, ponad 100 tys. ton dziennie
lub ok. 5 mln m3/h w jednostkach energetycznych rzędu
1000 MW, stwarzają całkiem nową skalę w projektowaniu procesu. Dodatkową
trudnością jest zmienny strumień i skład spalin odbiegający od ustalonego,
z którym ma się do czynienia zwykle w przemyśle chemicznym.
Metody odsiarczania dzieli się na:
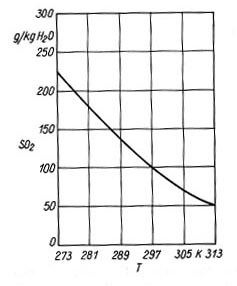
Metody mokre Metoda wapniowo-wapienna Metoda wapniowo-wapienna jest procesem nieregeneracyjnym z punktu widzenia odzysku siarki oraz roztworu reakcyjnego. Metoda oparta jest na absorpcji i reakcji chemicznej SO2 w zawiesinie wapna( CaO ) lub kamienia wapiennego ( CaCO3 ). Powstające w wyniku reakcji CaSO3 i CaSO4 w postaci szlamu lub wilgotnego ciała stałego w większości przypadków stanowią odpad. Podczas absorpcji SO2 w zawiesinie wodnej w pierwszym etapie zachodzą procesy 1) 2) 3) Rozpuszczalność SO2 w wodzie (rys. 1) jest funkcją temperatury i maleje z jej wzrostem. W praktyce ciecz nie stanowi czystej wody, lecz roztwór zawierający szereg rozpuszczonych soli, w tym głównie chlorkowych, w wyniku czego szybkość absorpcji ulega zwiększeniu. W przypadku gdy w roztworze absorpcyjnym znajduje się wapno CaO, podczas absorpcji zachodzić będą reakcje 4) 5) 6) 7)
W obecności tlenu jon siarczynowy może ulec utlenieniu zgodnie z reakcjami 8) 9)
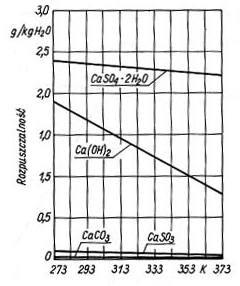
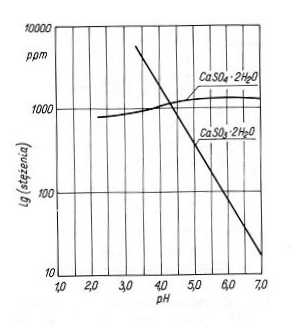
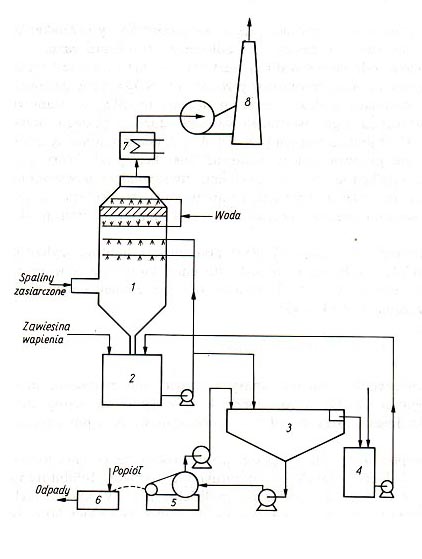
zależy od stężenia jonów H+ i koncentracji CaCO3. Proces absorpcji SO2 powinien być więc prowadzony w zawiesinie wapna przy pH ok. 8, w zawiesinie kamienia wapiennego przy pH ok. 6. Różnice pH w stosunku do wartości optymalnych są powodem tworzenia się twardego CaSO4 przy małym pH, który osiadając na ściankach powoduje blokowanie wnętrza aparatury. Szybkość tworzenia się siarczanu wg reakcji (7) i (8) przy małym pH jest większa, gdyż wzrasta rozpuszczalność siarczynu. Przy dużym pH powstaje osad stosunkowo miękki CaSO3, który blokuje przeloty przewodów. Rozpuszczalność CaSO3 i CaSO4 w zależności od pH przedstawiono na rys.3. W praktyce przebieg procesów chemicznych odsiarczania ze względu na obecność w układzie wielu soli, m.in. takich kationów jak Na, K, Mg, Fe, Al itd., jest bardziej skomplikowany, niż wynika to z przedstawionych powyżej reakcji. W procesie absorpcji zasadniczym zagadnieniem jest kontrola pH. W celu ograniczenia wahań pH ze zmianą stężenia SO2 w gazach odlotowych i tym samym zmniejszenia możliwości blokowania wnętrza aparatury procesowej oraz zwiększenia sprawności odsiarczania do roztworu absorpcyjnego wprowadza się różne dodatki. Jako dodatki stosowane są np. kwas adypinowy, benzoesowy, mrówkowy, węglany, tiosiarczan sodu. Schemat typowej instalacji do prowadzenia odsiarczania metodą wapniowo-wapienną przedstawiono na rys. 4.
W skład instalacji wchodzą następujące aparaty:
Metoda magnezowa (regeneracyjna)
Ditlenek siarki absorbowany jest w wodnym
roztworze soli magnezu. Produktem jest mieszanina siarczynów i siarczanów
magnezu. Po wysuszeniu mieszanina jest poddawana kalcynacji w wyniku odzyskuje
się tlenek magnezu i dwutlenek siarki kierowany do produkcji kwasu siarkowego.
Metody rozwojowe.
Jak wiadomo, w procesach absorpcji SO2
dominują roztwory wodne. Przez dodatek do wody różnego rodzaju substancji
można zmienić warunki równowagi na granicy faz gaz-ciecz oraz w głębi roztworu
i spowodować wzrost wydajności absorpcji nawet o kilka rzędów wielkości.
Efektywną metodą usuwania SO2 z odpylonych gazów jest absorpcja
SO2 w kolumnie z wypełnieniem zraszanym wodą utlenionę (opracowaną
przez firmę Degussa, RFN). Metoda ta umożliwia zmniejszenie stężenia SO2
w gazach odlotowych do atmosfery do ok. 20 mg/Nm3. Produktem
odsiarczania jest 70-proc. H2SO4.
W procesach metalurgicznych do odsiarczania
stężonych gazów odlotowych (do 5% SO2) Są stosowane metody
oparte na absorpcji SO2 w roztworach amin. Metody te umożliwiają
uzyskanie hSO2 > 99%, lecz są nieekonomiczne w przypadku odsiarczania
gazów rozcieńczonych z elektrociepłowni.
Trwają również badania nad procesem biologicznej
redukcji SO2 jako metody regeneracyjnej usuwania SO2 ze
spalin odlotowych.
Metody suche
Są doniesienia o próbach wiązania SO3 z substancjami alkalicznymi stałymi lub gazowymi w fazie gazowej. Np. wprowadza się rozdrobnioną sodę NaHCO3 do strumienia spalin. Pod wpływem temperatury soda rozkłada się do CO2 co zwiększa porowatość osadu i przyspiesza adsorpcję. W przypadkach stosowania węgli aktywnych jako adsorbentów SO2 w ich porach powstaje H2SO4. Adsorpcja prowadzona jest w temp. 390 - 420 K. Regenerację prowadzi się gazem obojętnym w temperaturze ok. 670 K, przy czym zachodzi reakcja pomiędzy węglem a H2SO4 z wytwarzaniem stężonego SO2 do produkcji H2SO4 :
lub siarki elementarnej przez redukcję odpowiednim gazem np. H2S: 3H2S + H2SO4 ® 4S + 4H2O (15) Jako adsorbenty m ogą być stosowane tlenki metali manganu, miedzi, które reagują do odpowiednich siarczków. Regeneracja następuje w wyniku reakcji z wodorem, CO lub węglowodorami odzyskuje się SO2.Główną wadą metod adsorpcyjnych są duże wymiary aparatów rzędu 100 m 3.Metodę absorpcji SO2 wykorzystano w suszarni rozpyłowej gdzie spaliny przepływają przez rozpyloną wodna zawiesinę węglanu lub wodorotlenku wapnia. Zachodzi absorpcja i reakcja chemiczna. Wysoka temperatura suszarni powoduje odparowanie wody i produktem jest sucha mieszanina siarczynu i siarczanu wapnia.Porównanie metod mokrych i suchychPorównanie mokrych i suchych metod odsiarczania dotyczyć może m. in. zapotrzebowania reagentów i energii, gromadzenia i neutralizacji odpadów, eksploatacji i obsługi oraz ekonomiki procesu. Zasadniczy etap odsiarczania metodami mokrymi przebiega w skruberze przed skierowaniem gazów do komina. W wyniku kontaktu z wodą lub z roztworem następuje schłodzenie gazów do temperatury ok. 320 K, co jest temperaturą niższą od tzw. normalnej temperatury kominowej, ok. 420 K. Stanowi to poważna wadę metod mokrych oprócz konieczności stosowania specjalnych materiałów konstrukcyjnych w strefie mokrej instalacji. Gazy oczyszczone przed skierowaniem do komina muszą być podgrzewane. W metodach mokrych przenoszenie masy do czynnej powierzchni ciekłego reagenta jest zdecydowanie lepsze, niszczenie absorbentu nie stanowi problemu. Możliwe komplikacje wynikać mogą z reakcji ubocznych i odwrotnych. Usuwanie wody z produktu jest kosztowne. Metody suche przy osiąganiu tej samej sprawności wymagają nieco większego stosunku stechiometrycznego sorbentu do SO2. Wielkość ta jest minimalizowana poprzez recyrkulację produktów odsiarczania z pozostałością niewykorzystanego sorbentu w przypadku metod odpadowych. Stosowane w metodach suchych sorbenty są jednak bardziej kosztowne, lecz zużycie wody jest o ok. 50% mniejsze lub woda nie jest stosowana. W większości procesów odsiarczania koszt
reagentów ocenia się na 25-35% kosztów eksploatacji. Koszty
te mogę być zmniejszone, gdy istnieją możliwości wykorzystania odpadowych
cieczy alkalicznych (m. in. w przemyśle metalowym, tekstylnym, papierniczym).
Zapotrzebowanie energii w metodach suchych jest mniejsze w wyniku wyeliminowania operacji z bardzo dużymi objętościami strumieni cieczy lub zawiesin oraz podgrzewania oczyszczonych gazów. W mokrej metodzie wapniowo-wapiennej wymienione operacje zużywają 60-75% całości doprowadzonej energii. W przypadku, gdy odsiarczanie jest procesem odpadowym, metody suche umożliwiają lepsze wykorzystanie istniejących środków transportu i stwarzają mniej problemów z gromadzeniem odpadów. Produkty odsiarczania (z wyjątkiem soli sodowych) są praktycznie nierozpuszczalne, łatwe do przetworzenia na niepylący granulat o różnym zastosowaniu. W metodach suchych nie stosuje się wielu aparatów koniecznych w metodach mokrych oraz nie występuje problem blokowania wnętrza aparatury osadami i korozji. Potrzebna jest mniejsza liczba aparatów w instalacji, co ułatwia eksploatację przy zmniejszonej obsłudze. Zmniejsza to koszty inwestycyjne i eksploatacyjne. Metody suche odpadowe są o ok. 30-40% tańsze od metod mokrych w porównywalnych warunkach. Stąd metody suche odpadowe są preferowane w procesach oczyszczania gazów z mniejszych źródeł emisji, szczególnie z odpylaniem końcowym w filtrach tkaninowych i granulowaniem produktów oczyszczania. Do wad metod suchych odsiarczania stosujących stałe sorbenty zalicza się małą efektywność wykorzystania ziaren sorbentu, małą prędkość gazu, duże straty sorbentu podczas regeneracji. Wysoki koszt istniejących technologii odsiarczania ogranicza ich stosowanie szczególnie w krajach pozornie oszczędzających i przyspieszających rozwój kosztem ochrony środowiska. Metody regeneracyjne odsiarczania są na ogół bardziej kosztowne niż odpadowe. Ich koszt inwestycyjny jest o 15 -40% większy, a eksploatacyjny do 60% w stosunku do metod mokrych odpadowych. Powyższy tekst przygotowano w oparciu o fragmenty książek: J.Warych, “Oczyszczanie przemysłowych gazów odlotowych” PWN, 1994. Pr. zbiorowa pod redakcja J.Adamca, “Ćwiczenia
z chemii i technologii oczyszczania gazów”.
Literatura podstawowa:
Literatura uzupełniająca:
|