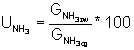|
WYDZIAŁ CHEMII - ZAKŁAD DYDAKTYCZNY TECHNOLOGII CHEMICZNEJ ĆWICZENIE NR 10 Ciągły proces otrzymywania sody metodą Solvaya

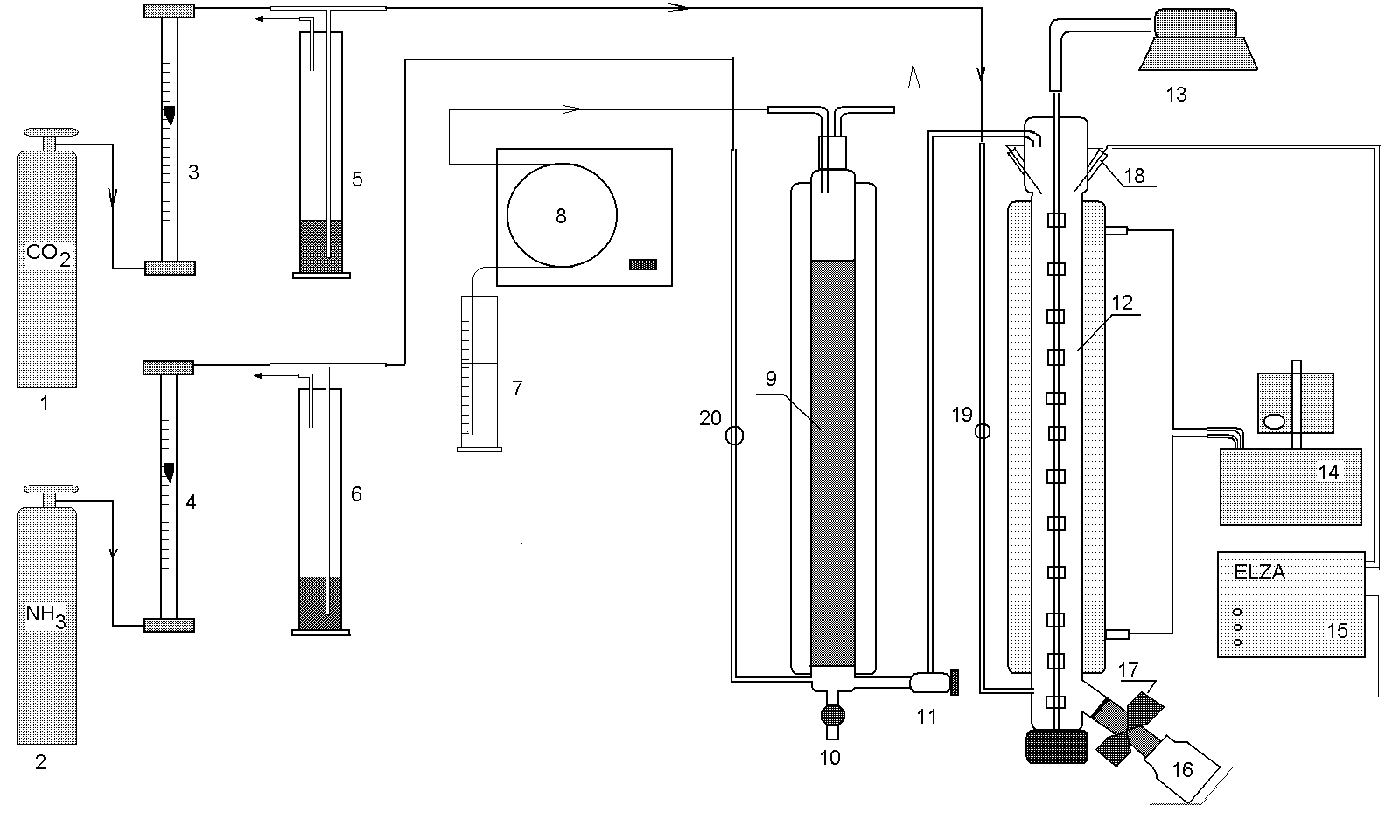
Cel ćwiczenia: Przedstawienie przemysłowej metody ciągłej karbonizacji solanki amoniakalnej i otrzymywania wodorowęglanu sodowego (bikarbonatu). W ramach ćwiczenia ograniczymy się do dwóch pierwszych etapów metody Solvaya. 1.Opis aparatury. Schemat aparatury został przedstawiony na rys.1. Jej główne elementy stanowią kolumna z wypełnieniem i płaszczem chłodzącym (9) służąca do pochłaniania amoniaku oraz karbonizator (12) zaopatrzony w płaszcz grzewczy oraz mieszadło z szeregiem łopatek. Do górnej części kolumny absorpcyjnej (9) doprowadzana jest pompą (8) solanka z cylindra miarowego (7). Amoniak z butli (2) podawany jest na dół kolumny poprzez zbiornik wyrównawczy. Pomiar przepływu amoniaku odczytywany jest na rotametrze (4). Solanka amoniakalna odprowadzana jest dołem kolumny i przelewem wprowadzana do karbonizatora (19). Karbonizator posiada płaszcz grzewczy połączony z termostatem (14). Zamiast półek typowych dla przemysłowej kolumny karbonizacyjnej (tzw. paset) w karbonizatorze zainstalowano długie mieszadło z szeregiem łopatek zapewniające dobre rozprowadzenie CO2 a zarazem pozwalające uniknąć zatykania przewodów przez wytrącający się bikarbonat. Ditlenek węgla wprowadzany jest do karbonizatora od dołu z butli (1) poprzez rotametr (3) i manostat (5). Odprowadzenie zawiesiny bikarbonatu odbywa przez elektrozawór (17) połączony ze sterownikiem (15). Sterownik rozwiera szczęki odbieralnika w chwili, gdy poziom zawiesiny w karbonizatorze zrówna się z wysokością na jakiej został umieszczony elektryczny czujnik (18). Natomiast zamknięcie szczęk następuje natychmiast po obniżeniu się wysokości słupa zawiesiny poniżej poziomu czujnika. Tym samym ciągłe pompowanie solanki oraz odprowadzanie zawiesiny bikarbonatu zapewnia ciągłość procesu technologicznego.
fot. Joanna Kaczyńska-Walczak
Schemat aparatury dla ciągłej produkcji bikarbonatu metodą Solvay’a. (dla powiększenia kliknij na obrazku) 1- butla z CO2, 2 – butla z NH3, 3, 4 – rotametry, 5, 6 – manostaty, 7 – cylinder miarowy z solanką, 8 – pompa perystaltyczna, 9 – kolumna z wypełnieniem do absorpcji amoniaku. 10, 11 – zawory, 12 – kolumna z mieszadłem do karbonizacji solanki amoniakalnej, 13 – silnik mieszadła, 14 – termostat, 15 – sterowanie elektrozaworem, 16 – odbieralnik produktu, 17 – elektrozawór, 18 – elektrody, 19, 20 – zawory.
2.Cząść analityczna. 2.1. Analiza solanki - oznaczanie NaCl w roztworze początkowym. Odpipetować 10 ml roztworu do kolby miarowej o pojemności 250 ml i rozcieńczyć wodą redestylowaną do kreski. Z otrzymanego roztworu odpipetować 5 ml do erlenmajerki, rozcieńczyć niewielką ilością wody, dodać kilka kropli nasyconego roztworu K2CrO4 i miareczkować 0,1 molowym roztworem AgNO3 do pojawienia się brunatnego zabarwienia. Zawartość NaCl,
GNaCl:
v - liczba mililitrów
0,1M AgNO3 zużytych do miareczkowania.
2.2. Analiza roztworu znad bikarbonatu Przesączyć około
20 ml roztworu znad bikarbonatu przez karbowany sączek do suchej erlenmajerki.
Odpipetować 10ml przesączu do kolby miarowej o pojemności 250 ml i rozcieńczyć
wodą redestylowaną do kreski - tak otrzymany roztwór jest podstawowym
roztworem do wykonania wszystkich poniżej opisanych analiz.
- Oznaczania chloru oraz wolnego i słabo związanego amoniaku. Z otrzymanego
roztworu podstawowego pobrać 5ml, przenieść do erlenmajerki i rozcieńczyć
niewielką ilością wody. Zmiareczkować 0,1M HNO3
wobec oranżu metylowego ( zmiana barwy z żółtej w środowisku zasadowym
na czerwoną w środowisku kwaśnym pH 3-4) w celu określenia ilości amoniaku
wolnego i słabo związanego. Następnie dodać kilka kropli nasyconego roztworu
K2CrO4
i zmiareczkować 0,1M AgNO3
do pojawienia się brunatnego zabarwienia. Zawartość amoniaku wolnego i
słabo związanego oraz Cl-
obliczyć ze wzorów [2]i [3] .
Zawartość amoniaku
wolnego i słabo związanego, GNH3
w:
v - liczba mililitrów
0,1M HNO3
zużytych na miareczkowanie
Zawartość chloru
w roztworze GCl-
:
v - liczba mililitrów
0,1n AgNO3
zużytych do miareczkowania.
- Oznaczanie amoniaku całkowitego. Odpipetować 5 ml roztworu podstawowego do erlenmajerki. Zobojętnić 0,1M HNO3 wobec oranżu metylowego. Następnie dodać 4ml 40%-owego roztworu aldehydu mrówkowego uprzednio zobojętnionego wobec fenoloftaleiny i pozostawić na okres 1 minuty do przereagowania. Wydzielony kwas miareczkować 0,5M NaOH wobec fenoloftaleiny do różowego zabarwienia. Całkowitą zawartość
amoniaku GNH3og
oblicza się w/g wzoru 4.
v - liczba ml
0,1M NaOH zużytego na miareczkowanie.
3. Wykonanie ćwiczenia. UWAGA ! W czasie wykonywania ćwiczenia obowiązuje noszenie okularów ochronnych. Operacje z butlami zawierającymi NH3 i CO2 wykonywać wyłącznie w obecności asystenta. 1. Napełnić cylinder (7) ( 1L) solanką. 2. Określić gęstość solanki przez zważenie 1 litra roztworu NaCl. 3. Umieścić wąż doprowadzający solankę do pompy (8) w cylindrze (7). 4. Sprawdzić czy są zamknięte zawory (10 ) i (11). Włączyć pompę (8) i na maksymalnych obrotach napełnić solanką z cylindra kolumnę absorpcyjną (9) do poziomu odpowiadającego wysokości przelewu do karbonizatora. 5. Włączyć przepływ wody chłodzącej kolumnę absorbcyjną. 6. Otworzyć zawór (20) a następnie uruchomić przepływ amoniaku z butli (2) i regulując zaworem na butli ustawić żądany przepływ na rotametrze (4). Wartość przepływu podaje opiekun. W trakcie nasycania solanki amoniakiem należy bardzo pilnować aby nie spadł przepływ amoniaku kontrolując jego wartość na rotametrze. 7. Prowadzić nasączanie solanki amoniakiem do momentu osiągnięcia żądanego stężenia NH3 w roztworze. – podniesie się poziom roztworu w kolumnie do zadanej wysokości. 8. W międzyczasie oznaczyć chlorek sodu w solance wg. pkt. 2.1. 9. Po osiągnięciu żądanego stężenia NH3 nałeży obniżyć przepływ amoniaku i włączyć termostat (14). 10. Sprawdzić czy jest zamknięty zawór (17). Otworzyć zawór (11) łączący kolumnę (9) z karbonizatorem (12). Uruchomić ponownie pompę (8), co umożliwi napełnienie solanką amoniakalną karbonizator (12). Poziom solanki w karbonizatorze powinien znajdować się ok. 10cm poniżej poziomu czujników. W tym momencie należy wyłączyć pompę (8). 11. Włączyć mieszadło karbonizatora i odczekać aż temperatura solanki amoniakalnej osiągnie w karbonizatorze 50oC. 12. Otworzyć zawór (19) i uruchomić przepływ CO2, którego wartość również określa asystent. Przepływ ditlenku węgla kontrolujemy na rotametrze(5). 13. Po około 1 godz. karbonizacji, gdy w karbonizatorze powstanie biały, drobny osad bikarbonatu należy podstawić zważony odbieralnik pod zawór (17) włączyć sterownik (15) oraz pompę (8). Natężenie przepływu solanki (szybkość pompowania) ustala asystent. Rozpoczyna się odbieranie zawiesiny bikarbonatu do odbieralnika. 14. Po upływie 0,5 godz. należy zmienić odbieralnik i zważyć go wraz z zawartością. Ze zważonej mieszaniny poreakcyjnej w odbieralniku należy pobrać ok. 20ml roztworu w celu oznaczenia zawartości chloru, amoniaku wolnego i słabo związanego, amoniaku ogólnego w/g pkt.2.2. Następnie należy odsączyć osad na sączku pod zmniejszonym ciśnieniem, przemyć nasyconymi roztworami wodnym i alkoholowym bikarbonatu i zważyć w stanie wilgotnym. 15. Ćwiczenie można uznać za zakończone jeżeli przy stałych przepływach NH3, CO2 oraz solanki uzyskamy zbliżone masy poszczególnych próbek bikarbonatu oraz zbliżone wyniki analiz. 16. Po zakończeniu ćwiczenia należy wysuszyć próbki bikarbonatu do stałej masy.
4. Opracowanie wyników. Na podstawie otrzymanych wyników należy obliczyć następujące wielkości: 4.1. Stopień wykorzystania sodu Stopień wykorzystania sodu UNa obliczamy dwiema metodami: - jako stosunek
ilości moli NH4Cl
w roztworze końcowym ( roztwór nad bikarbonatem) do początkowej ilości
moli NaCl ( wprowadzonej z roztworem solanki).
GCl-
zawartość chloru w roztworze znad bikarbonatu.
GNH3zw
- amoniak związany w roztworze znad bikarbonatu obliczony w/g wzoru:
- Stopień wykorzystania
sodu obliczony z wydajności wagowej bikarbonatu W:
GNaCO3
- waga suchego osadu bikarbonatu w g/h.
s - ilość NaCl
wprowadzona do karbonizacji z roztworem solanki (g/h).
4.2.
Stopień wykorzystania amoniaku UNH3
GNH3zw
- amoniak związany w roztworze nad bikarbonatem.
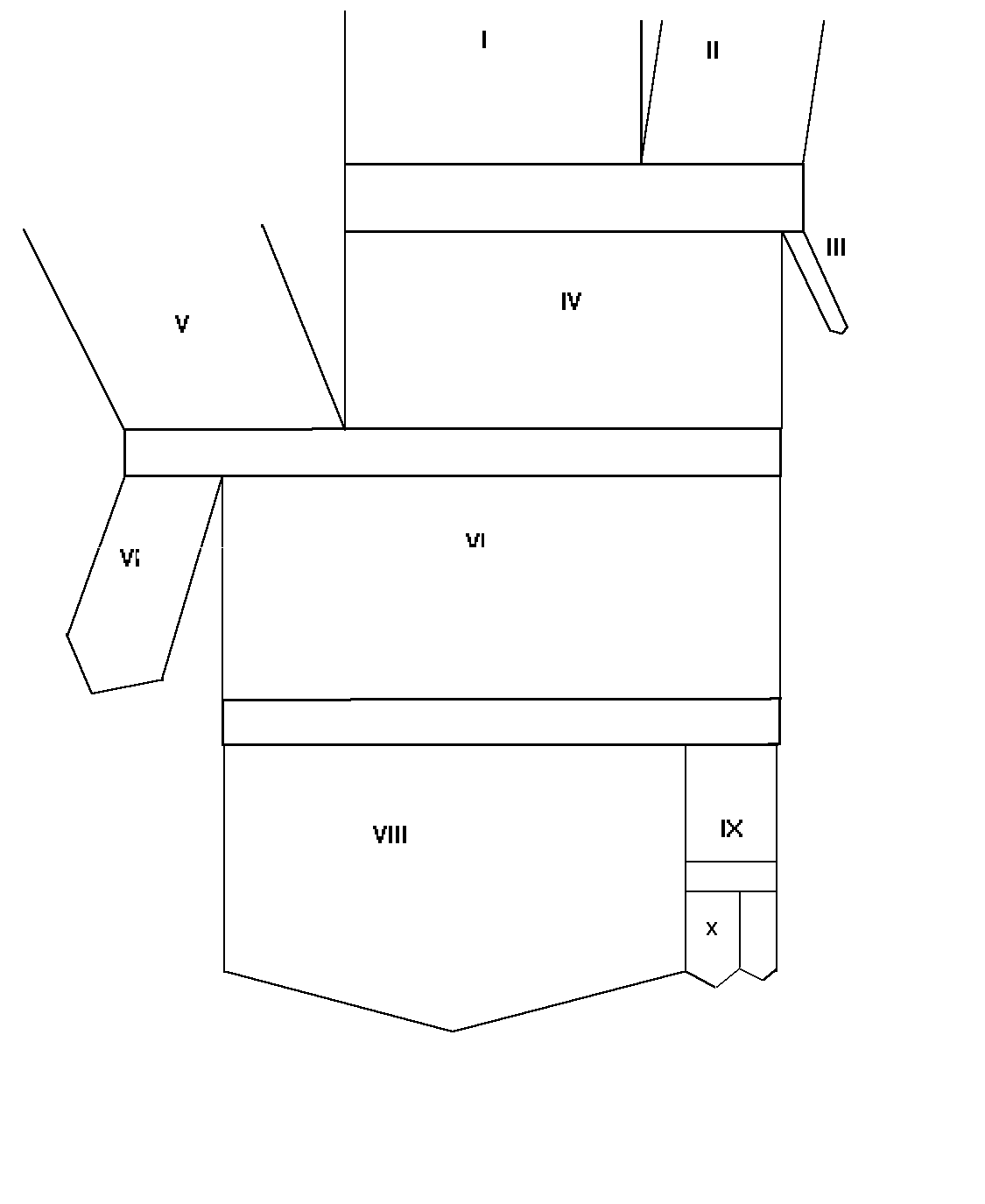
4.3. Wyliczyć wszystkie strumienie i wykonać bilans materiałowy procesu. Obliczyć straty. 4.4. Wykonać
wykres Sankey’a na papierze milimetrowym opierając się na załączonym schemacie
zachowując proporcje strumieni. Należy określić podstawę bilansu
Dla powiększenie wykresu kliknij TUTAJ 
|