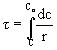|
Katalityczne spalanie jako metoda oczyszczania gazów przemysłowych Instrukcja wykonania ćwiczenia nr 18 Opracowanie dr inż. Jadwiga Skupińska Celem ćwiczenia jest przedstawienie metody katalitycznego utleniania węglowodorów jako wysoce wydajnej metody oczyszczania gazów odlotowych. W ćwiczeniu oczyszczanie powietrza przeprowadza się w przepływowym, izotermicznym reaktorze z nieruchomą warstwą katalizatora. Katalizatorem jest platyna naniesiona na tlenek glinu w ilości 0,1% wagowych. Jako przykład substancji stanowiącej zanieczyszczenie powietrza wybrano heksan. Heksan wybrano, ponieważ jest on głównym składnikiem benzyny ekstrakcyjnej. Benzyna ekstrakcyjna jest powszechnie używanym rozpuszczalnikiem w lakierniach i warsztatach samochodowych. Wprowadzenie do ćwiczenia. W ćwiczeniu badamy reakcję utlenienia heksanu wobec platyny na tlenku glinu jako katalizatora. Reakcja jest prowadzona w sposób ciągły w izotermicznym reaktorze ze stałym złożem katalizatora. Mieszanina powietrza zanieczyszczona heksanem przepływa z góry do dołu. Dla tego sposobu prowadzenia reakcji charakterystyczne jest, że gdy warunki reakcji ustabilizują się, stopień przemiany nie zmienia się w czasie. Zależy on od czasu przebywania substratu w reaktorze. Przez złoże katalizatora przepływa
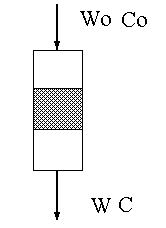
gaz jak pokazano na rysunku.
Wo – objętościowe natężenie
przepływu na wlocie do reaktora [ml/h lub l/h]
W – objętościowe natężenie przepływu
na wylocie z reaktora [ml/h lub l/h]
Co – ilość moli heksanu
na wlocie reaktora [mmol/h]
C – ilość moli heksanu na wylocie
reaktora [mmol/h]
Przebiega reakcja:
Reakcja utlenienia heksanu jest prowadzona
w dużym nadmiarze tlenu i jest reakcją pierwszego rzędu w stosunku do heksanu
[1].
Na wlocie do reaktora prędkość objętościowa
powietrza wynosi Wo [ml/h], stężenie heksanu Co a ilość moli
heksanu jest no. Na wylocie ilość moli heksanu wynosi n a stężenie
C. Stopień konwersji
szybkość reakcji ( sumaryczna szybkość
procesu heterogenicznego) wyrażamy prędkością zmian stężenia substratu:
Czas przebywania w reaktorze można
określić przez całkowanie tego równania
w wyniku całkowania w założonych
granicach i podstawiając za r wartość z wzoru (2) otrzymamy zależność:
Podstawiając do wzoru (5) wyrażenia
na stopień konwersji (3) otrzymamy:
Zależność (6) pozwala obliczyć średni
czas przebywania reagentów w reaktorze konieczny dla uzyskania stopnia
konwersji a. Czas przebywania w reaktorze można obliczyć także z równania
(7):
Vk = objętość katalizatora
Vo = szybkość objętościowa
substratu w jednostkach objętości na jednostkę czasu.
Literatura
1. Heterogeneous catalytic reactions
involving molecular oxygen – wyd. Elsevier 1983r str.455.
Opis ćwiczenia
Reakcja prowadzona jest w kwarcowym,
przepływowym reaktorze z nieruchomą warstwą katalizatora. Reaktor jest
ogrzewany elektrycznie. Katalizatorem jest platyna naniesiona na tlenek
glinu w ilości 0,1%. Wielkość ziarna katalizatora 2 – 3 mm. Nad katalizatorem
umieszczono kawałki kwarcu i stanowią one strefę wstępnego ogrzewania powietrza
wprowadzanego do reaktora od góry. Powietrze przed wejściem do reaktora
przepływa przez płuczkę z heksanem i regulując szybkość przepływu zmieniamy
stężenie heksanu w powietrzu. Zawartość heksanu w strumieniu wchodzącym
do reaktora i wychodzącym z reaktora jest określana metodą chromatografii
gazowej na chromatografie firmy Hewlett-Packard GC 6859. Próbki do analizy
są pobierane bezpośrednio z układu reakcyjnego strzykawką do gazów i natychmiast
nastrzykiwane do chromatografu. Po odczytaniu pól pików z krzywej wzorcowej
wyznacza się ilość heksanu w 1 ml powietrza.
Gazy po wyjściu z reaktora są chłodzone
w chłodnicy z płaszczem wodnym. Aby wyznaczyć optymalne warunki prowadzenia
procesu należy zmieniać temperatury reakcji, szybkość przepływu powietrza
zanieczyszczonego heksanem oraz ilość katalizatora.
Zestaw aparatury.
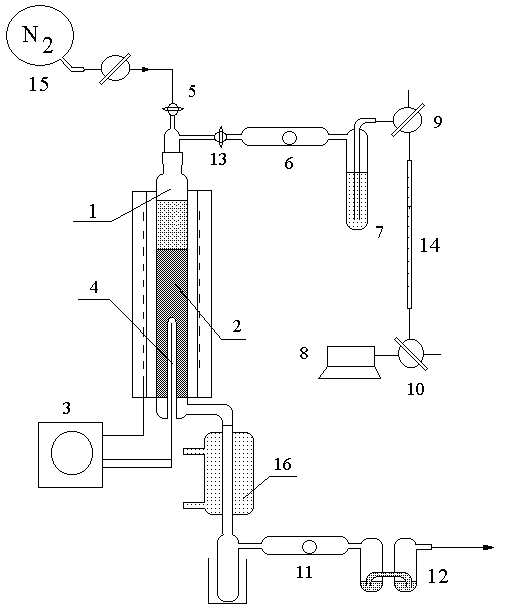
Na schemacie przedstawiono zestaw
aparatury dla ćwiczenia 18. Reakcja prowadzona jest w izotermicznym, reaktorze
(1) z nieruchomym złożem katalizatora (2). Temperatura wewnątrz reaktora
jest mierzona za pomocą termopary (4) i kontrolowana za pomocą programatora
temperatury (3). Powietrze pompowane pompką (8) przepływa przez płuczkę
(7) i wchodzi do reaktora. Gazy poreakcyjne chłodzone są w chłodnicy (16)
i kierowane są przez płuczkę (12) do kanału wyciągowego. Próbki powietrza
do analiz pobiera się przez septy (6) i (11). Po reakcji katalizator jest
przepłukiwany azotem z balona (15).
Wykonanie ćwiczenia.
Na podstawie wyników uzyskanych w
ćwiczeniu należy obliczyć
Wyniki uzyskane w czasie wykonywania
ćwiczenia: a, toraz stała 1/kCo powinny być podstawą do rozwiązania
następującego problemu:
Warsztat samochodowy emituje do atmosfery
XX m3 gazu w ciągu doby zawierającego YY% benzyny ekstrakcyjnej.
Obliczyć jaka objętość katalizatora jest potrzebna ( katalizator ten sam
jak w ćwiczeniu) dla oczyszczenia gazu z benzyny ekstrakcyjnej z wydajnością
99%.
|