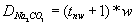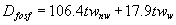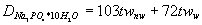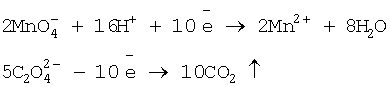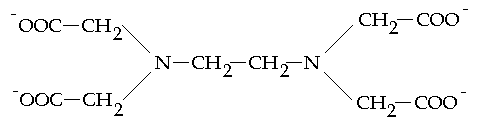ZAKŁAD DYDAKTYCZNY TECHNOLOGII CHEMICZNEJ Zapraszamy do odwiedzania strony www Zakładu - proszę tu kliknąć . ĆWICZENIE NR 3
Obecnie (Styczeń 2025) instalacja w pokazanej formie już nie istnieje. Po remoncie sali najprawdopodobniej nie zostanie zrekonstruowana.
|
 |
. OPRACOWAŁ Wersja 2014/2015 10.07.2015 |
 |
|
|
| Wprowadzenie.
Ujęcia wody Wymagania jakościowe. Woda przeznaczona do spożycia przez ludziUzdatnianie wody Metoda jonitowa. |
Przebieg
ćwiczenia - Część procesowa.
a) Regeneracja jonitów.Przebieg ćwiczenia - Część analityczna. 1) Miano roztworu KMnO4Opracowanie wyników Wymagania do kolokwium Literatura |
Wprowadzenie
Woda, H2O ,tlenek wodoru , jest jednym z najważniejszych i najbardziej rozpowszechnionych w przyrodzie związków chemicznych. Jej cząsteczka jest dipolem. Występuje w stałym obiegu wskutek działania energii słonecznej oraz siły ciężkości. Elementami składowymi cyklu są opady atmosferyczne, odpływ i parowanie. Około 4/5 opadów trafia bezpośrednio do oceanu światowego, reszta na powierzchnię lądów. Woda stanowi jedną z geosfer, tzw. hydrosferę. Zajmuje ona ponad 2/3 powierzchni Ziemi. Znajduje się również w skałach skorupy ziemskiej, oraz w postaci pary wodnej w atmosferze. W rejonach biegunów Ziemi występuje w stanie stałym jako trwała pokrywa lodowa, w wysokich partiach gór tworzy lodowce. Występuje także w stanie związanym jako woda konstytucyjna, krystalizacyjna i zeolityczna. Część wody trafiająca z opadów na powierzchnię lądów wyparowuje z powrotem do atmosfery, pozostała zaś część bądź spływa bezpośrednio z powierzchni lądów, bądź wsiąka do gleby, infiltrując w grunt. Część jej zostaje pobrana przez rośliny, a część po osiągnięciu wód gruntowych spływa ku źródłom, mokradłom, rzekom, jeziorom i oceanom tworząc tzw. odpływ podziemny.Można przyjąć, że objętość wszystkich wód ziemskich wynosi 1360*106 km3[1]. Naturalne wody stanowią zwykle rozcieńczone roztwory różnych soli, zawierające rozpuszczone gazy, zawiesiny mineralne oraz mikroorganizmy takie jak bakterie i inne drobnoustroje. Obecność w wodzie poszczególnych składników zależy od jej pochodzenia. Stosunkowo najczystsze są wody opadowe, zwykle zawierają niewielkie ilości rozpuszczonych gazów, głównie azotu, tlenu, dwutlenku węgla, w mniejszych ilościach dwutlenku i trójtlenku siarki (kwaśne deszcze).
Woda jest jednym z podstawowych składników żywych organizmów. Umożliwia przebieg procesów przemiany materii, a także bierze udział w wielu z tych procesów. Dla licznych roślin i organizmów wodnych stanowi jedyne środowisko, w którym mogą przebywać. Między roślinami i ich otoczeniem zachodzi nieustanna wymiana wody, co ma bardzo ważne znaczenie dla ogólnego bilansu krążenia wody w przyrodzie.
Woda znajduje szerokie zastosowanie: używana jest do spożycia, do celów gospodarczo bytowych, w rolnictwie i w przemyśle. Ze względu na duże ciepło właściwe i ciepło parowania używana jest jako nośnik ciepła w chłodnictwie, ogrzewnictwie i energetyce. Energię potencjalną wód płynących zamienia się na elektryczną w hydroelektrowniach i jest to źródło tzw. energii odtwarzalnej, nie zanieczyszczającej środowiska. Jako dobry rozpuszczalnik woda stanowi środowisko wielu reakcji chemicznych. Używana jest do rozdzielania substancji metodą flotacji lub sedymentacji, do przemywania osadów, oczyszczania substancji przez krystalizację itp. Jest również substratem wielu procesów chemicznych, np. otrzymywania kwasów, zasad itp. Jest surowcem do otrzymywania wodoru i tlenu. W przyszłości wodór może mieć zastosowanie jako paliwo czyste ekologicznie.
W Polsce gospodarowanie wodami reguluje "Prawo Wodne", Ustawa z dnia 30 maja 2014 roku. W zakresie swojej regulacji ustawa dokonuje wdrożenia postanowień dyrektyw Unii Europejskiej.
Więcej o wodzie dowiesz się tu - WARTO ZAJRZEĆ
Ujęcia wody
Aby moc korzystać z zasobów wodnych występujących na Ziemi należy posłużyć się obiektem inżynieryjnym zwanym ujęciem wody. W zależności od tego z jakiego zbiornika woda będzie czerpana ujęcia można podzielić na:a) ujęcia wód podziemnych,
b) ujęcia wód powierzchniowych
c) ujęcia źródeł
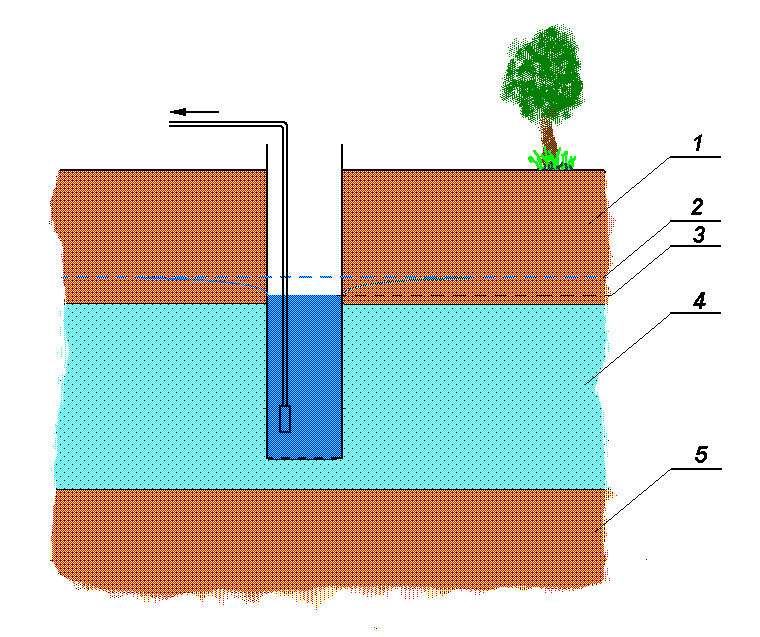
Ujęcie wód podziemnych to obiekty i urządzenia przeznaczone do zdrenowania warstw wodonośnych i czerpania z nich wody. [8] Ujęcia wody podziemnej dzieli się na pionowe (studnie) i poziome (systemy drenażowe). Rys.-3 przedstawia schematycznie przekrój przez warstwy powierzchni Ziemi, w których znajduje się studnia ujmująca wodę z warstwy wodonośnej.
Rys. - 3. 1- grunt rodzimy, 2 - poziom wód gruntowych, 3 - lej depresyjny wywołany pompowaniem wody ze studni, 4 - warstwa wodonośna (żwiry, piaski), 5 - warstwa nieprzepuszczalna (np. glina). Dla powiększenia rysunku, kliknij myszą.
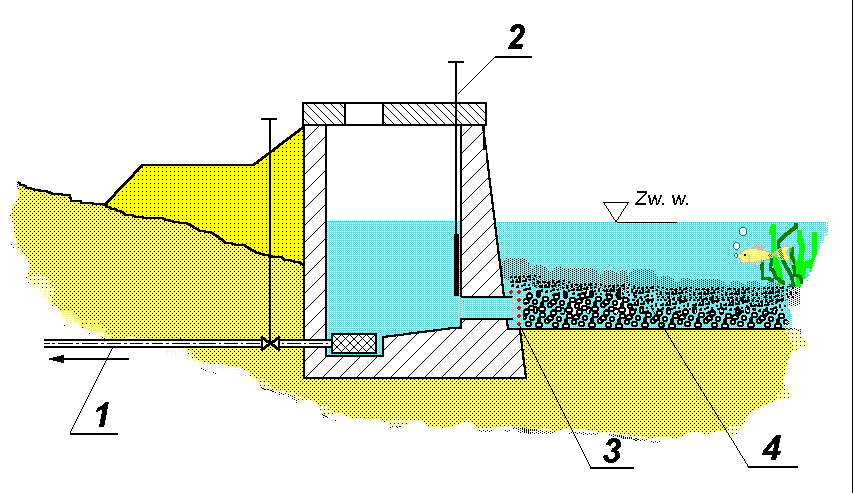
Ujęcie wód powierzchniowych stanowią obiekty inżynieryjne w postaci np. progów piętrzących. Piętrzenie ułatwia czerpanie wody również w czasie "niżówek", czyli okresów niewielkiego ilościowo spływu wody w cieku. Spiętrzona woda trafia przez system krat zabezpieczających ujęcie przed zanieczyszczeniami grubymi do koryta i komory zbiorczej, skąd przez odstojnik, w którym osiadają zanieczyszczenia drobne (piasek), woda kierowana jest do komory czerpalnej. Mogą to być również obiekty zlokalizowane na brzegu rzeki lub jeziora wyposażone w system filtracji na złożu piaskowo-żwirowym. Rys -2.
Rys. - 2. 1- przewód ssący, 2 - zasuwa, 3 - krata, 4 - warstwa drenująco-filtracyjna (żwir, tłuczeń); Dla powiększenia rysunku, kliknij myszą.
Systemy drenażowe stosuje się również instalując je promieniście pod dnem rzeki (np. studnia "Gruba Kaśka" Wodociągu Warszawskiego - Zakład Wodociągu Praskiego), a odbiór wody z drenów zachodzi grawitacyjnie w centralnie usytuowanej studni szybowej. Oprócz wielu zalet, takich jak usunięcie z wody glonów, większości bakterii, mętności, zawartości żelaza i manganu, metoda ta pozwala także zabezpieczyć ujecie przed naglymi zanieczyszczeniami wody np. substancjami ropopochodnymi, które utrzymują się zazwyczaj na powierzchni rzeki.
"Gruba Kaśka" jest największą eksploatowaną w Polsce studnią z promienistym systemem drenów. Jej głębokość wynosi 40, średnica 11 metrów, a dreny są ułożone ok. 6...7 m pod powierzchnią dna. Jej wydajność wynosi 185 tys. m3 na dobę. [6][6a]
Interesujacy artykuł --> TUTAJ

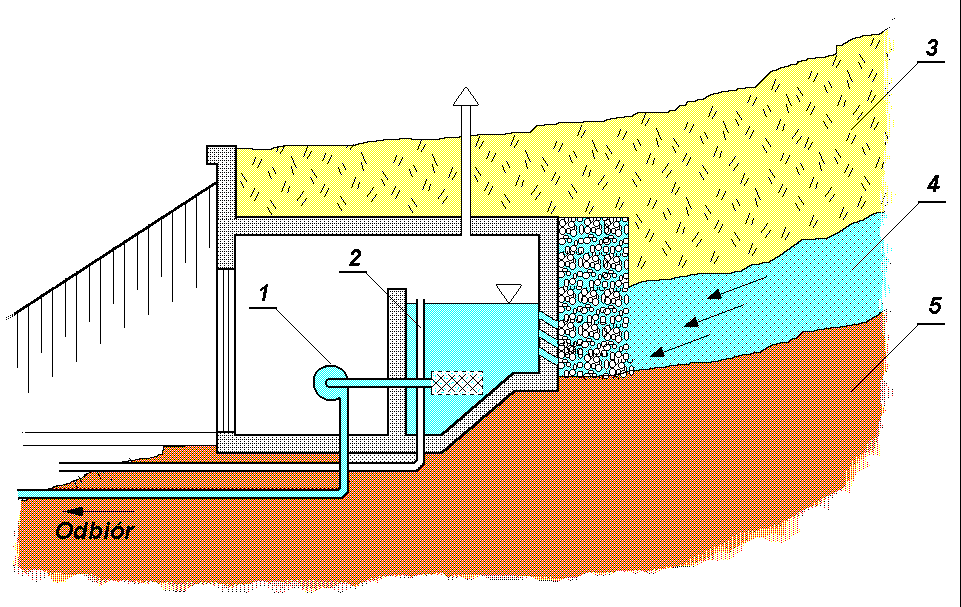
Ujęcia źródeł, czyli miejsc samorzutnego wypływu wód podziemnych na powierzchnię, pozwalają na właściwe wykorzystanie ich wydajności, a przy wydajności przekraczającej zapotrzebowanie uwolnienie nadmiaru wody i kierowanie jej do cieku wodnego znajdującego się poniżej. Rysunek poniżej.
Rys - 1. Pompa, 2 - przelew, 3 - grunt rodzimy, 4 - warstwa wodonośna, 5 - warstwa nieprzepuszczalna; Dla powiększenia rysunku, kliknij myszą.
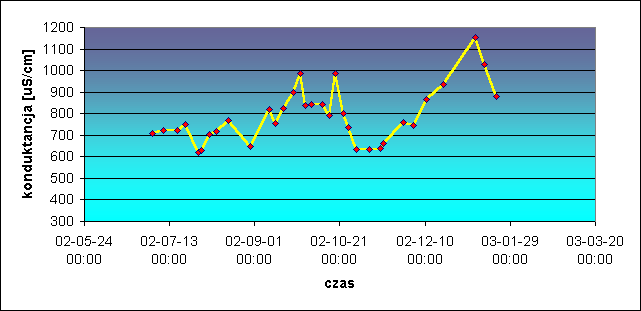
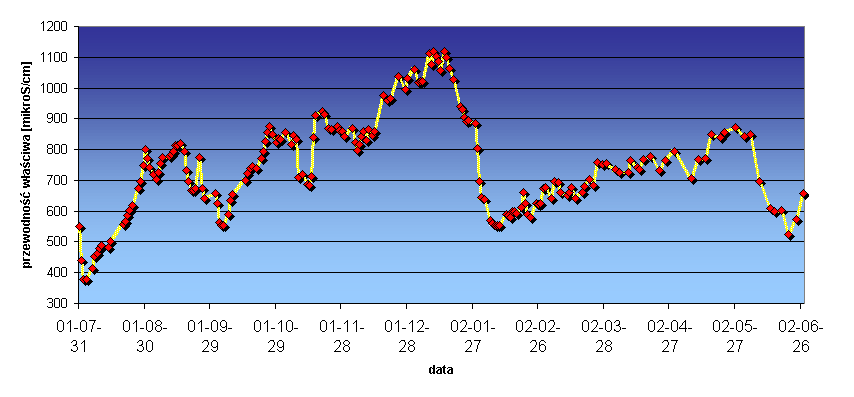
Wody powierzchniowe bywają zanieczyszczone wskutek działalności człowieka (przemysłowej, komunalnej i rolniczej). W zależności od pory roku ich skład zmienia się znacznie mając największe stężenia soli mineralnych ( w tym również NaCl np. w przypadku Wisły pochodzącego m. in. z wód dołowych nadwiślańskich kopalń węgla), a także innych zanieczyszczeń w okresach mroźnej zimy i suchego lata, substancji organicznych i amoniaku w okresach zakwitu glonów, jednocześnie wykazując najmniejsze zasolenia w okresach wiosennych roztopów i wysokich wód powodziowych w czerwcu - lipcu. Wykres poniżej ilustruje zmiany przewodności właściwej wody z Warszawskiego Wodociągu Centralnego, której ujęcia znajdują się na brzegu i pod dnem Wisły. Monitoring prowadzony był od połowy roku 2001 do wiosny roku 2003. Przewodność można uznać jako wielkość w przybliżeniu proporcjonalną do zasolenia wody, przy założeniu, że strumień wód zasolonych zrzucany w zlewni Wisły pozostaje stały.
Daje się wyróżnić duże rozcieńczenie wodami opadowymi pod koniec lipca 2001 (groźna powódź w zlewni Wisły) skutkujące rocznym minimum przewodności, okres silnego zasolenia na przełomie 2001 /2002 (mroźna zima) i spływu śniegów w drugiej połowie stycznia 2002 - (odwilż). [10a].
Wymagania jakościowe.
wody o takiej jakości, aby nadawała się do wszystkich zastosowań. Wymaga ona zatem wstępnego uzdatnienia. Uzdatnianie może przyjąć różne formy - od mechanicznego oczyszczenia, przez filtrację, dezynfekcję aż po zmiękczanie i demineralizację. Aby zatem zdecydować jakim procesom ma być poddana woda, należy wcześniej przyjąć kryteria przydatności dla konkretnego zastosowania.
Aktami prawnymi obowiązującymi w Polsce dotyczącymi jakości wody przeznaczonej do spożycia przez ludzi są:
Dyrektywa Rady 98/83/WE z dnia 3 listopada 1998 r.w sprawie jakości wody przeznaczonej do spożycia przez ludzi oraz Rozporządzenie Ministra Zdrowia z dnia 29 marca 2007 r. w sprawie jakości wody przeznaczonej do spożycia przez ludzi z późniejszymi zmianami.
Woda przeznaczona do spożycia i do zastosowań gospodarczych powinna być przede wszystkim nieszkodliwa dla zdrowia człowieka i zwierząt oraz czysta i smaczna. Nie zawierać bakterii - np. Eschericha coli - 0 w próbce 100 ml, zawiesin, manganu nie więcej niż 0,050 mg/l i żelaza poniżej 0,200 mg/l . Powinna natomiast zawierać sole wapnia i magnezu - do 500 mg/l w przeliczeniu na CaCO3 oraz rozpuszczony CO2. Pożądana jest zawartość mikroelementów.
Woda dla przemysłu spożywczego. Ogólnie powinna odpowiadać tym samym kryteriom jak woda przeznaczona do spożycia przez ludzi, lecz w przypadku np. browarów powinna zawierać mniejszą ilość rozpuszczonych soli (być miękka), mleczarni - nie zawierać rozpuszczonego tlenu, bakterii, żelaza i manganu.
Woda dla innych gałęzi przemysłu. Podczas gdy dla wody spożycia przez ludzi i dla przemysłu spożywczego uwzględnia się przede wszystkim wymagania sanitarne, to dla wód przemysłowych zasadniczą rolę odgrywa jej skład chemiczny oraz parametry fizyczne. Woda powinna zatem być miękka - nie zawierać rozpuszczonych soli i gazów. Powinna posiadać w miarę stałą temperaturę, niezależnie od pory roku. Nie zawierać zanieczyszczeń stałych pochodzenia organicznego i nieorganicznego.
Wskaźniki jakości wody
Wskaźniki fizyczne
Mętność
Mętność wody wywołują zawiesiny organiczne jak np. związki humusowe i nieorganiczne takie jak trudno rozpuszczalne wodorotlenki metali np. Fe(OH)3 , Mn(OH)2 , iły, gliny itp. Mętność wody przeznaczonej do spożycia przez ludzi nie powinna przekraczać 1,0 NTU (nefelometrycznych jednostek mętności) w wodzie po uzdatnieniu. (Pomiary mętności)
Barwa
Woda chemicznie czysta nie ma barwy. W warunkach naturalnych w grubych warstwach przymuje odcień błękitu. Wody zanieczyszczone przyjmują zabarwienie od związków chemicznych w nich rozpuszczonych. Jest to najczęściej zabarwienie zielono-żółte. Jako układ odniesienia przyjmuje się koloidalny wodny roztwór platyny (1 mg / dm3 = 10 skali platynowej).
Smak i zapach
Są to parametry badane organoleptycznie. Smak i zapach nadają wodzie rozpuszczone w niej związki nieorganiczne takie jak sole, kwasy, gazy i organiczne - najczęściej produkty metabolizmu organizmów żyjących w wodzie w warunkach naturalnych. Rozporządzenie Min. Zdrowia określa te wymagania jako "akceptowalne przez konsumentów i bez nieprawidłowych zmian"
Temperatura
Jest funkcją energii cząsteczek. Ten parametr ma podstawowe znaczenie w technice cieplnej (chłodnictwo), a także w przemyśle spożywczym.
Wskaźniki chemiczneJako chemiczne wskaźniki jakości wody przyjmuje się: odczyn, utlenialność, zawartość substancji azotowych, chlorków, siarczanów, fosforanów, żelaza, manganu, krzemu, magnezu i wapnia (twardość), zasadowość, suchą pozostałość, rozpuszczone gazy itp.
Najistotniejsze z nich omówione zostaną niżej.
Odczyn
Wskazuje on, czy woda jest kwaśna czy alkaliczna. Odczyn większości wód naturalnych waha się w granicach 6,8-8,5 pH.
Zasadowość
Jest to własność wody spowodowana obecnością wodorotlenków, wodorowęglanów i węglanów Ca2+, Mg2+, K+, Na+. Zasadowość może być zatem pochodzenia wodorowęglanowego, węglanowego i wodorotlenowego. Oznacza się dwa rodzaje zasadowości:
- typu "p" przez miareczkowanie HCl wobec fenoloftaleiny jako wskaźnika (pH przejścia = 8,2...8,3),
- typu "m" przez miareczkowanie HCl wobec oranżu metylowego jako wskaźnika (pH przejścia = 4,6...4,3).
Zasadowość typu "p" jest wywołana przez wodorotlenki, typu "m" jest sumą zasadowości wywołanych przez węglany, wodorowęglany, monowodorofosforany, diwodorofosforany itd. aż do pH = 4,3 .
Wody naturalne wykazują zasadowość tylko wobec oranżu metylowego.W technice kotłowej oznacza się również tzw.liczbę alkaliczną
LA = p 40
gdzie: p - zasadowość wobec fenoloftaleiny.
Utlenialność (ChZT)
Służy umownie do określenia substancji organicznych zawartych w wodzie. Oznacza się ją kilkoma metodami. Wartość ChZT oznaczana metodą nadmanganianową jest umowna, gdyż tylko ok. 60% substancji organicznych zawartych w wodzie ulega utlenieniu.
Gdy ilość jonów Cl- jest mniejsza od 300 mg/dm3, utlenialność oznacza się w środowisku kwaśnym. Jeśli zawartość chlorków przewyższa 300 mg/dm3, należy stosować oznaczanie w środowisku zasadowym.
Twardość
Jest to zawartość jonów wapniowych i magnezowych w wodzie. Twardość wyraża się ilością milivali jonów wapniowych i magnezowych w decymetrze sześciennym wody. Do jej wyrażania stosowane są również tzw. stopnie twardości:
- niemiecki stopień twardości (0n) odpowiadający zawartości soli wapniowych i magnezowych
równoważnej 10 mg CaO w 1 dm3 wody,
- francuski stopień twardości (0f) odpowiadający zawartości soli wapniowych i magnezowych
równoważnej 10 mg CaCO3 w 1 dm3 wody,
- angielski stopień twardości (0 Clarka) odpowiadający zawartości soli wapniowych i magnezowych
równoważnej 14,3 mg CaCO3 w 1 dm3 wody.
Jak przeliczyć zawartość kationów Ca+2 i Mg+2 w wodzie
na twardość wyrażoną w on, of i oClarka? - kliknij tutaj.
Może się przydać podczas kolokwium.

Laboratoryjna, dwustopniowa destylarka do wody. Ścianki kotła pierwszego stopnia (1) i wężownic w chłodnicach (2), zasilane wodą wodociągową, pokryte są warstwą kamienia. Brązowa barwa kamienia pochodzi od związków żelaza (III), strącających się wspólnie z węglanami wapnia i magnezu.
Twardość jest cechą, która powoduje powstawanie kamienia kotłowego w urządzeniach grzewczych. W gospodarstwie domowym utrudnia pranie przez zwiększenie zużycia środków piorących. Na ogólną twardość składa się twardość węglanowa i niewęglanowa. Twardość węglanową nadają wodzie rozpuszczone wodorowęglany wapnia i magnezu. Można ją usunąć przez ogrzewanie wody do wrzenia. Pozostałe aniony i kationy tworzą tzw. twardość niewęglanową, której nie da się usunąć powyższym sposobem. Niewęglanową twardość tworzą rozpuszczone chlorki, siarczany, krzemiany, tj. jony Ca2+ i Mg2+ równoważne ilościowo anionom Cl-, SO42-, SiO32-.
tog = tw + tnw
Stosując inny podział mówi się o twardości stałej i przemijającej.
tog = tst+ tprzem
Twardość stała pozostaje w wodzie po doprowadzeniu jej do wrzenia pod normalnym ciśnieniem. Następuje wtedy rozkład wodorowęglanów i wytrącenie węglanów:
Ca2+ + 2 HCO3- ==> CaCO3 + CO2 + H2O
Ponieważ część węglanów pozostaje w wodzie w postaci rozpuszczonej, w szczególności MgCO3, który dopiero po długotrwałym gotowaniu próbki rozkłada się na:
MgCO3 + H2O ==> Mg(OH)2 + CO2
dlatego twardość przemijająca jest mniejsza od twardości węglanowej:
tprzem < tw
Stopień zanieczyszczenia wody bakteriami określa się na podstawie liczby bakterii w przyjętej objętości wody (100 lub 250 ml). Ocena wody pod względem sanitarno-epidemiologicznym odbywa się na podstawie miana coli (bakterii okrężnicy). Okrężnica, to odcinek jelita grubego. Miano coli oznacza najmniejszą objętość wody wyrażonej w mililitrach, w której wykryto 1 bakterię okrężnicy. Ich występowanie sugeruje możliwość istnienia w wodzie również bakterii chorobotwórczych. Im mniejsze jest miano coli, tym woda jest bardziej zanieczyszczona. Dla wody nadającej się do picia powinno wynosić 100 i powyżej. [Więcej]
Tabela
Pełna analiza wody głębinowej z poziomu oligoceńskiego
Przykład wody konsumpcyjnej dobrej jakości.
UJĘCIE WARSZAWA - URSYNÓW, SGGW. Głębokość ujęcia - 265 m*
Mętność 2,0 mg / dm3 Twardość ogólna 5 mVal/dm3 Twardość magnezowa 1,4 mVal/dm3 Zawartość wapnia 40 mg / dm3 Zawartość żelaza 0,25 mg / dm3 Zawartość magnezu 17,1 mg / dm3 Zawartość manganu 0,05 mg / dm3 Zawartość glinu 0,00 mg / dm3 Zawartość fluoru 0,62 mg / dm3 Zawartość chlorków 103 - 250 mg / dm3 Zawartość amoniaku 0,02 mg / dm3 Zawartość azotynów 0,01 mg / dm3 Zawartość azotanów 1,0 mg / dm3 Zawartość siarkowodoru 0,0 mg / dm3 Zawartość siarczanów 0.0 mg / dm3 Zawartość fosforanów 0,1 mg / dm3 Zawartość dwutlenku węgla 11,0 mg / dm3 Zawartość tlenu rozpuszczonego 3,6 mg / dm3 Zawartość krzemionki 40,0 mg / dm3 Sucha pozostałość 545,0 mg / dm3 *Analizę wykonała:
Wojewódzka Stacja Sanitarno-Epidemiologiczna Warszawa, ul. Żelazna 79.
Uzdatnianie wody
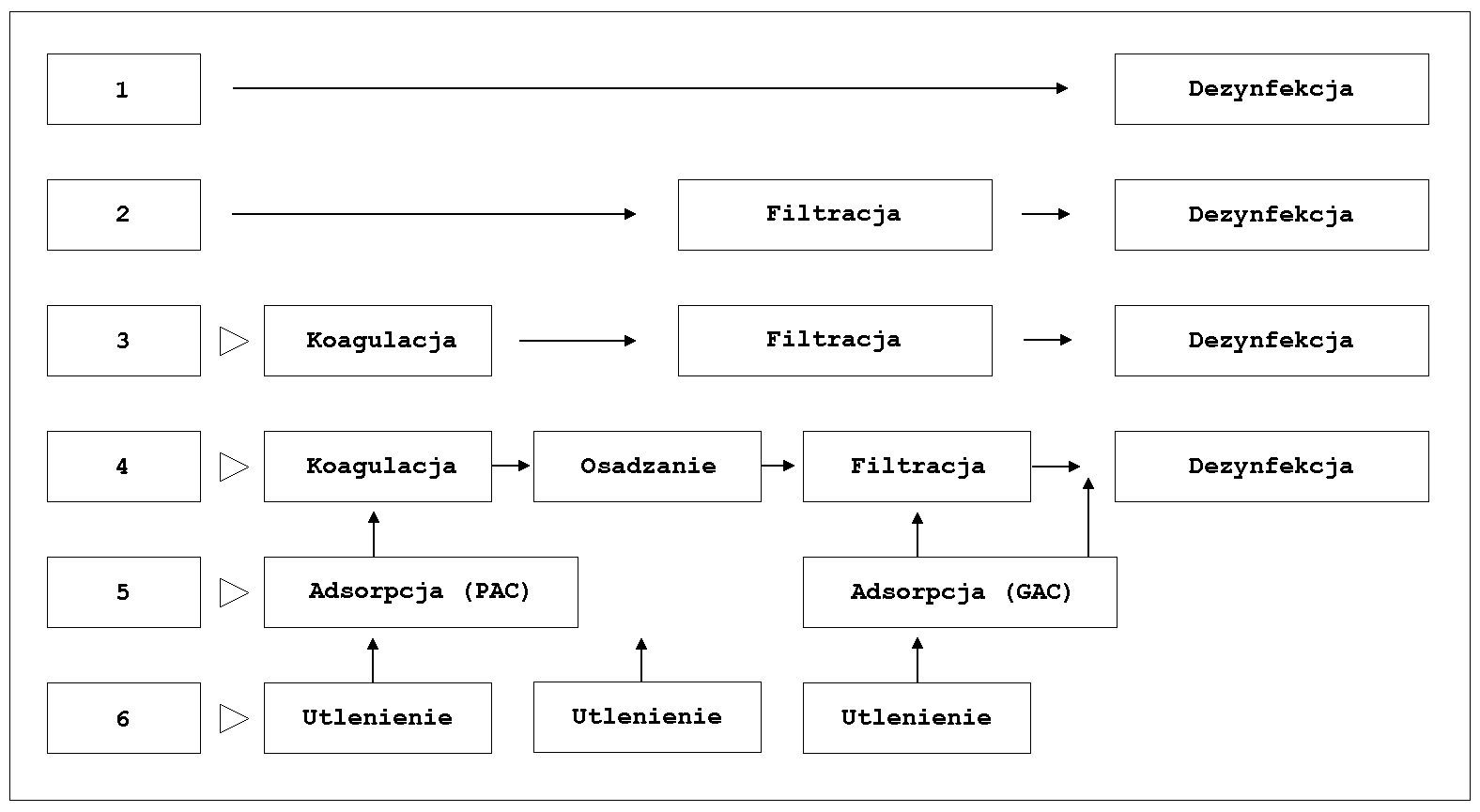
W instalacjach do uzdatniania wody stosuje się szereg połączonych procesów jednostkowych. Rysunek 1 przedstawia jedną z możliwości rozwiązania uzdatniania wody do zastosowań bytowo - gospodarczych .
Rys. 1 Uzdatnianie (PAC - węgiel aktywny proszkowany, GAC - węgiel aktywny granulowany).Dla powiększenia proszę kliknąć myszą
Operacje
Klarowania dokonuje się na kilka sposobów np. przez koagulację zoli, sedymentację zawiesin i filtrację, to jest usuwanie zanieczyszczeń za pomocą przepuszczania wody przez ośrodek porowaty - filtr.
Koagulację prowadzi się w celu wytrącenia koloidów znajdujących się w wodzie, a następnie osadza się je i filtruje. Do koagulacji stosuje się: Al2(SO4)3 (pH = 5,5 - 7,4 ), NaAlO2 (pH = 7), FeCl3 (pH > 4), FeSO4 (pH =8,5).Z powodu punktu izoelektrycznego, koagulację prowadzi się przy różnych wartościach pH.
W procesie koagulacji wyróżnia się dwa etapy:
- proces chemiczny, polegający na hydrolizie i reakcji koagulanta z substancjami zasadowymi w wodzie,
- proces fizykochemiczny polegający na zobojętnianiu ładunków i zlepianiu się cząstek koloidowych oraz powstawaniu kłaczków z jednoczesnym zjawiskiem adsorpcji i absorpcji.
W związku z tym proces prowadzi się dwustopniowo:
- dodawanie koagulanta i szybkie lecz krótkie mieszanie (1 - 2 min.)
-dłuższe i powolne (15 - 30 min) mieszanie, w czasie którego odbywa się flokulacja, tj. narastanie początkowo utworzonych kłaczków i adsorpcja przez nie bardzo drobnych zawiesin i cząstek koloidalnych.
Proces ten pozwala wytrącić z wody znaczną część zawiesin, co oszczędza filtry i wydłuża czas pomiędzy ich płukaniem.Odżelazianie i odmanganianie przeprowadza się napowietrzając wodę zanieczyszczoną manganem i żelazem, co powoduje wytrącenie się osadów wodorotlenków, które następnie są usuwane w wyniku filtracji na odpowiednich filtrach. Zwiększenie pH przez dodatek Ca(OH)2 powoduje szybszy przebieg procesu.
Wody podziemne często zawierają żelazo w postaci jonów Fe2+. Jest to powstały wskutek działania CO2 dwuwęglan żelazawy Fe(HCO3)2 lub siarczan żelazawy FeSO4. Jeżeli zawartość żelaza przekracza 0,3 mg/dm3 wodę należy oczyszczać. Żelazo w postaci dwuwodorowęglanu łatwo hydrolizuje do Fe(OH)2, a następnie utlenia się tlenem z powietrza do Fe(OH)3. Proces przebiega w środowisku obojętnym i zasadowym.
Jeżeli pH < 7, należy wstępnie usunąć CO2 przez napowietrzanie lub wapnowanie. Wapnowania wymagają wody zawierające żelazo w postaci FeSO4:FeSO4 + Ca(OH)2 ==> Fe(OH)2 + CaSO4
Dalszy proces przebiega jak wyżej. Mangan towarzyszy żelazu jako dwuwęglan Mn(HCO3)2 lub siarczan MnSO4. Węglan jest strącany podobnie jak żelazo, siarczan wymaga zastosowania odpowiednio uformowanego złoża manganowego. Są to wypełnienia ceramiczne pokryte dwutlenkiem manganu MnO2.
Dezynfekcja ma na celu zniszczenie bakterii i mikroorganizmów zawartych w wodzie. Dokonuje się tego przez chlorowanie, ozonowanie oraz naświetlanie promieniami ultrafioletowymi.
Chlorowanie wody prowadzi się przez dozowanie wody chlorowej. Zachodzą wtedy następujące reakcje:
Cl2 + H2O ==> HClO + HCl
HClO ==> H+ + OCl-
Jon OCl- jest aktywnym środkiem utleniającym i dezynfekcyjnym. Dawka chloru dla wody o przeciętnych własnościach wynosi 0,3 - 1 mg/dm3.
Ozon, O3, jest trójatomową odmianą alotropową tlenu. W atmosferze ziemskiej występuje w śladowych ilościach (10 - 6%) i dopiero w wyższych warstwach jego stężenie wzrasta. Można go otrzymać w aparatach zwanych ozonizatorami przez działanie wyładowaniem koronowym wysokiego napięcia na tlen gazowy. Również naświetlanie tlenu gazowego promieniami ultrafioletowymi (poniżej 190 nm) powoduje utworzenie ozonu.
Woda mieszana jest z ozonem w mieszalnikach eżektorowych i nasycona przepływa przez kolumnę kontaktową, gdzie zachodzi proces dezynfekcji. Zużycie ozonu wynosi 0,6 - 4 mg/m3, czas kontaktu z wodą ok. 10 min.
Cząsteczka ozonu ulega rozkładowi tworząc tlen atomowy,
O3 ==> O2 + O
Tlen atomowy jest silnym środkiem utleniającym i bakteriobójczym.
Wodę można dezynfekować również przez bezpośrednie naświetlanie promieniami ultrafioletowymi.Odgazowanie ma na celu usunięcie gazów rozpuszczonych w wodzie. Jednym z nich jest dwutlenek węgla. W zależności od pH może występować jako:
- gazowy przy pH < 4,
- jon HCO3- przy pH = 8,4,
- jon CO32- przy pH > 10,5.
Ta część dwutlenku węgla, która jest niezbędna do zabezpieczenia przed rozkładem rozpuszczonych w H2O wodorowęglanów, nazwana jest agresywnym dwutlenkiem węgla. Jest on bardzo aktywny, powoduje korozję metali. Ponadto rozpuszcza CaCO3 , np. w betonie konstrukcyjnym. Agresywność wody wzrasta, gdy przy tym samym stężeniu agresywnego CO2 wzrasta zawartość soli. Wykorzystując spadek rozpuszczalności gazów wraz ze wzrostem temperatury, można je usunąć przez ogrzewanie wody. Obniżenie ciśnienia nad cieczą jest sposobem mniej energochłonnym i prowadzącym do podobnych rezultatów.
Zmiękczania wody dokonuje się wytrącając związki wapnia i magnezu, przez ogrzanie wody, co usuwa twardość przemijającą. Użycie reagentów chemicznych, takich jak wapno i soda, polifosforany itp. prowadzi do podobnych efektów. Zastosowanie wymieniaczy jonowych - jonitów, pracujących w cyklu sodowym, spowoduje wymianę jonów Ca2+ i Mg2+ z wody na jony Na+, co zmniejsza jej twardość .
Woda nieuzdatniona (twarda) wytwarza osady kamienia i mułu kotłowego. Są to ciała stałe o różnej gęstości i składzie, powstające wewnątrz kotłów i wymienników cieplnych w czasie ich eksploatacji i naruszające normalną pracę powierzchni przewodzącej ciepło. Kamień tworzy się na ściankach urządzeń, muł jest osadem nie związanym z powierzchnią grzejną, powstaje w warstwie wody kotłowej. Oprócz tego tworzy się tzw. kamień wtórny. Są to cząstki mułu, na których krystalizują substancje z roztworów przesyconych. Zlepiając się w nieobciążonych częściach aparatów, tworzą złogi kamienia wtórnego. Kamień powstaje w wodzie wrzącej. Im gwałtowniejsze wrzenie, tym łatwiej tworzą się osady mułu.
Kamień kotłowy jest złym przewodnikiem ciepła. Jego współczynnik przewodności wynosi 0,3 - 21 kJ/m h0C. Wartość współczynnika w mniejszym stopniu zależy od składu chemicznego kamienia kotłowego natomiast zależy od jego porowatości. Najmniejszym współczynnikiem przewodności cieplnej charakteryzuje się kamień krzemianowy (0,29 - 0,83 kJ/m h0C). Jest zatem najniebezpieczniejszy, doprowadza do lokalnych przegrzań kotłów i ich awarii.
Ze względu na skład chemiczny rozróżnia się:
- kamień węglanowy (CaCO3 i MgCO3),
- kamień siarczanowy (CaSO4),
- kamień krzemianowy (o podwyższonej zawartości związków krzemu).
Kamień węglanowy występuje najczęściej w wymiennikach, kondensatorach turbin parowych, kotłach zasilanych twardą wodą, np. destylacyjnych. Kamień krzemianowy tworzy się w najbardziej wytężonych częściach kotłów. W skład kamienia mogą wchodzić inne substancje, np. tlenki żelaza, oleje itp.
Poprawianie wody to najprostszy sposób zabezpieczania kotłów przed kamieniem. Polega on na dodawaniu do wody zasilającej węglanu lub wodorotlenku sodu. Zachodzą wtedy następujące reakcje:
Ca2+ + CO32- ==> CaCO3
Mg2+ + 2 OH- ==> Mg(OH)2
OH- + HCO3- ==> CO32- + H2O
CO32- + HOH ==> 2 OH- + CO2
Ze względu na zależność równowagi ostatniej reakcji od ciśnienia, metodę tę stosuje się w przypadku kotłów pracujących do ciśnienia 1,6 MPa.
Fosforany sodowe Na3PO4 i Na2HPO4 * 12H2O stosuje się w kotłach pracujących pod wyższym ciśnieniem. Działanie fosforanów nie powoduje wydzielania się produktów lotnych i pienienia wody. Zachodzą wtedy następujące reakcje:10Ca2+ + 6PO43- + 2OH- ==> Ca10(PO4)6(OH)2
3Mg2+ + 2PO43- ==> Mg3(PO4)2
Przy utrzymywaniu w wodzie kotłowej małego nadmiaru jonów PO43- zawartość jonów Ca2+ i Mg2+ jest tak mała, że nie powstają kamieniotwórcze osady krzemianu i siarczanu wapniowego.
Niskociśnieniowe kotły parowe można czyścić z kamienia metodą chemiczną, roztwarzając go w roztworach kwasów np. HCl. Aby zapobiec nadgryzaniu kotła, do roztworów czyszczących dodaje się inhibitorów korozji, takich jak furfurol, urotropina lub formaldehyd.Kamienie nierozpuszczalne w HCl, H2SO4, H3PO4 itp. rozpuszcza się fluorowodorem.
SiO2 + 4HF ==> SiF4+ 2H2O
W praktyce stosuje się fluorki amonu lub sodu w połączeniu z HCl. HCl wypiera z fluorków HF i dalej reakcja biegnie jak wyżej.
Zmiękczanie metodą wapno - soda jest jedną z metod zmiękczania strąceniowego. Prowadzi się ją w podwyższonej temperaturze ok. 60 - 800C. Dodatek wapna Ca(OH)2 powoduje strącenia węglanów wapnia, soda Na2CO3 strąca sole powodujące twardość niewęglanową. Zachodzą następujące reakcje:
Ca(OH)2 + Na2CO3 ==> CaCO3 + 2NaOH
CO2 + 2NaOH ==> Na2CO3 + H2O
CO2 + Ca(OH)2 ==> CaCO3 + H2O
Ca(HCO3)2+ Ca(OH)2 ==> 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 ==> 2CaCO3 + Mg(OH)2 + 2H2O
MgSO4 + Ca(OH)2 + Na2CO3 ==>Mg(OH)2 + CaCO3 + Na2SO4.
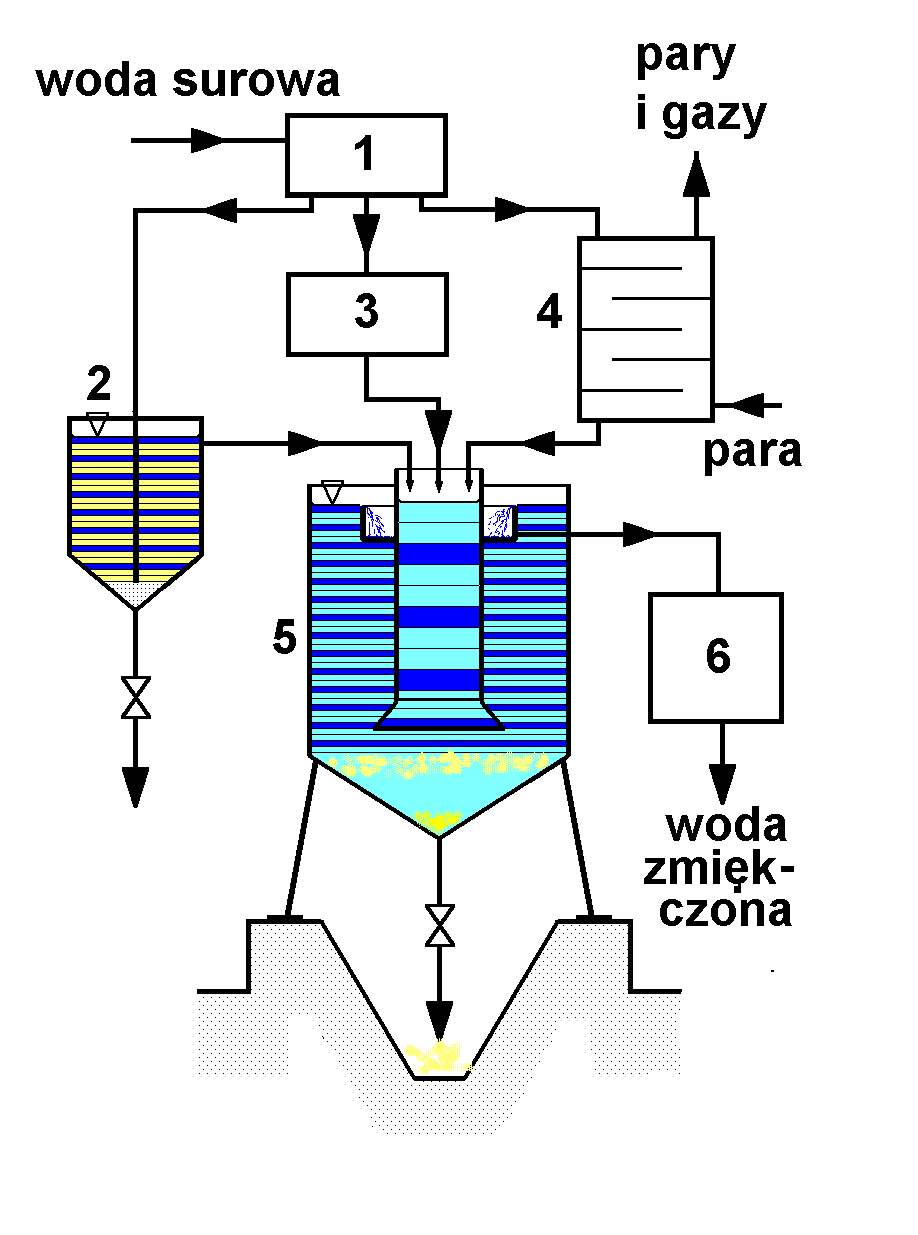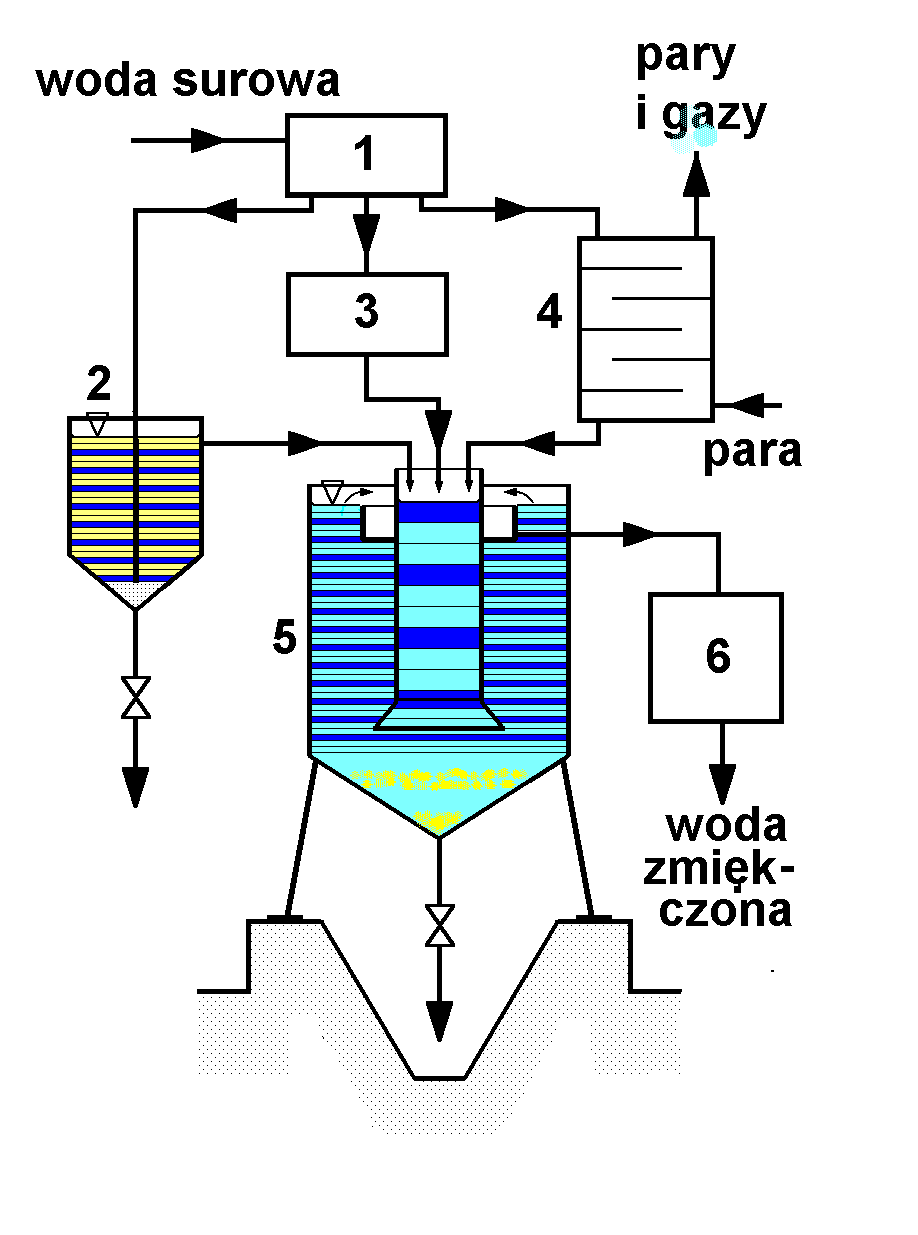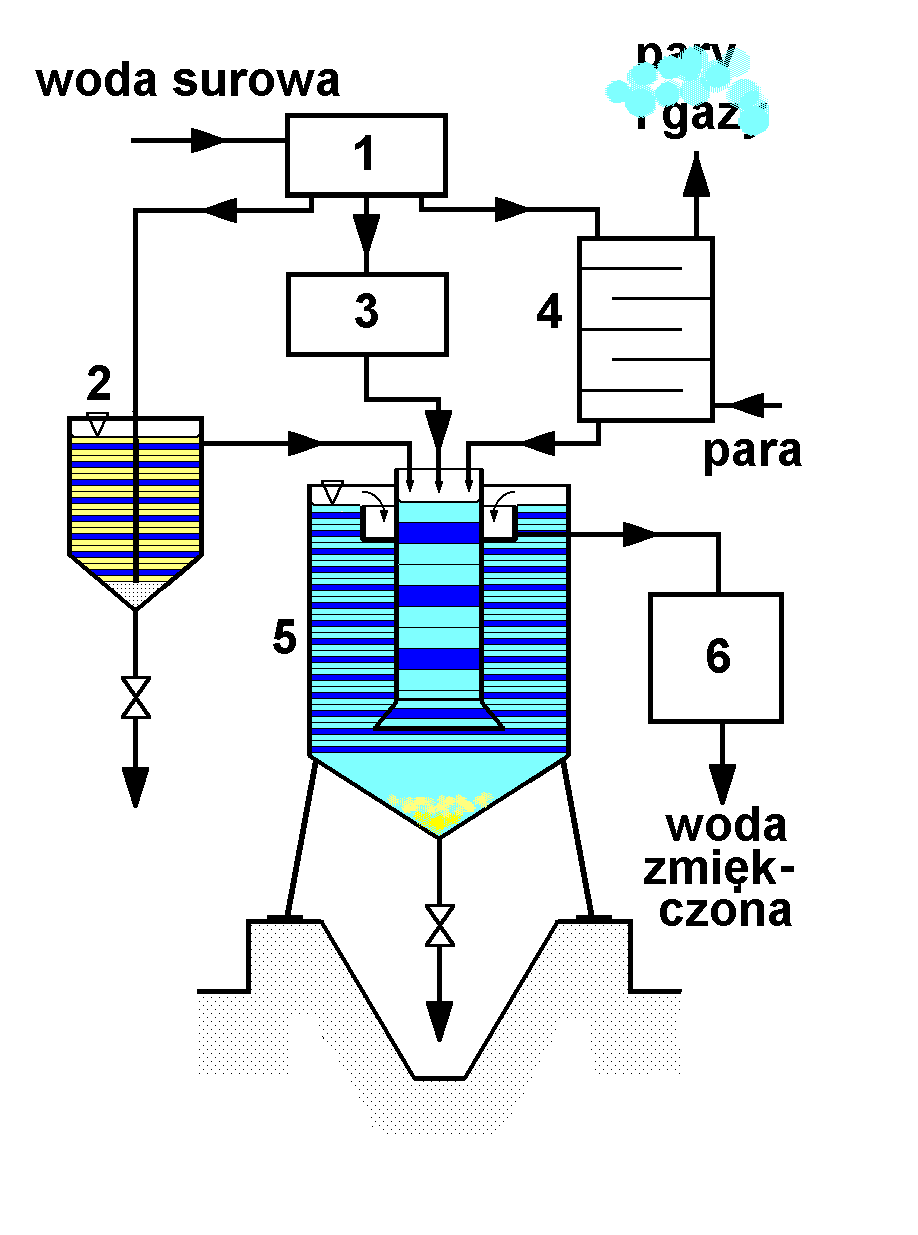
Schemat aparatu do zmiękczania wody metodą wapno-soda przedstawia rysunek poniżej. Twardość szczątkowa uzyskana tą metodą wynosi ok. 0,3 - 0,6 mval / dm3.
Opis schematu: 1 - główny rozdzielacz wody, 2 - sytnik wapna, 3 - zbiornik przygotowawczy roztworu sody, 4 - ogrzewacz kaskadowy, 5 - reaktor, 6 - filtr.
Działanie aparatury
Woda surowa z rozdzielacza kierowana jest do sytnika wapna, w którym jest nasycana wodorotlenkiem wapniowym ( stężenie Ca(OH)2 w nasyconym roztworze wodnym wynosi ok. 0.15% wagowego), do zbiornika przygotowawczego roztworu sody Na2CO3 i ogrzewacza kaskadowego. W ogrzewaczu strumień wody spływając po półkach spotyka się przeciwprądowo ze strumieniem pary grzejnej (system ogrzewania bezprzeponowego tzw. "parą ostrą"). Ciepło kondensacji pary podnosi temperaturę wody jednocześnie częściowo ją odgazowując.
Trzy strumienie mieszają się ze sobą w centralnej strefie reaktora, gdzie zachodzą opisane wcześniej reakcje chemiczne. W pobliżu dna reaktora strumień reagentów i produktów jest kierowany do zewnętrznej przestrzeni reaktora i zmniejsza liniową prędkość przepływu wskutek zwiększenia przekroju poprzecznego. Ułatwia to separację produktów stałych, jakimi są nierozpuszczalne sole i wodorotlenki. Opadają one do leja w dolnej części reaktora i w postaci szlamu okresowo usuwane są przez zawór.
Zmiękczona i wstępnie sklarowana woda kierowana jest przelewami do filtra, w którym zatrzymywane są drobniejsze frakcje osadów. Z filtra zmiękczona woda pobierana jest do użycia lub do dalszych operacji zmiękczania.
Dobór ilości i wzajemnego stosunku obu reagentów zależy od składu zmiękczanej wody.
Dawkę CaO [mg/dm3] można wyliczyć ze wzoru:
gdzie: tw - twardość węglanowa, tMg - twardość magnezowa, tCO2 - zawartość wolnego CO2 [mval/dm3],
w - współczynnik przeliczeniowy dla CaO = 28
Dawkę Na2CO3 można wyliczyć ze wzoru:
gdzie: tnw - twardość niewęglanowa [mval/dm3], w - współczynnik przeliczeniowy dla Na2CO3 = 53
Wartości stałe 0.5 i 1 określają nadmiar reagentów stosowany dla przeprowadzenia reakcji strącania całkowitego. [10]
Zmiękczanie fosforanami pozwala na usunięcie twardości węglanowej i niewęglanowej. Najlepsze efekty udaje użycie fosforanu trójsodowego Na3PO4 * 12H2O. Ponieważ jest to metoda kosztowna, stosuje się ją jako proces końcowy po wstępnym zmiękczeniu metodą wapno-soda. Procesowi towarzyszą następujące reakcje:
3Ca(HCO3)2 + 2Na3PO4 ==> Ca3(PO4)2 + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 ==> Mg3(PO4)2 + 6NaHCO3
3CaSO4 + 2Na3PO4 ==> Ca3(PO4)2 + 3Na2SO4
3MgSO4 + 2Na3PO4 ==> Mg3(PO4)2 + 3Na2SO4
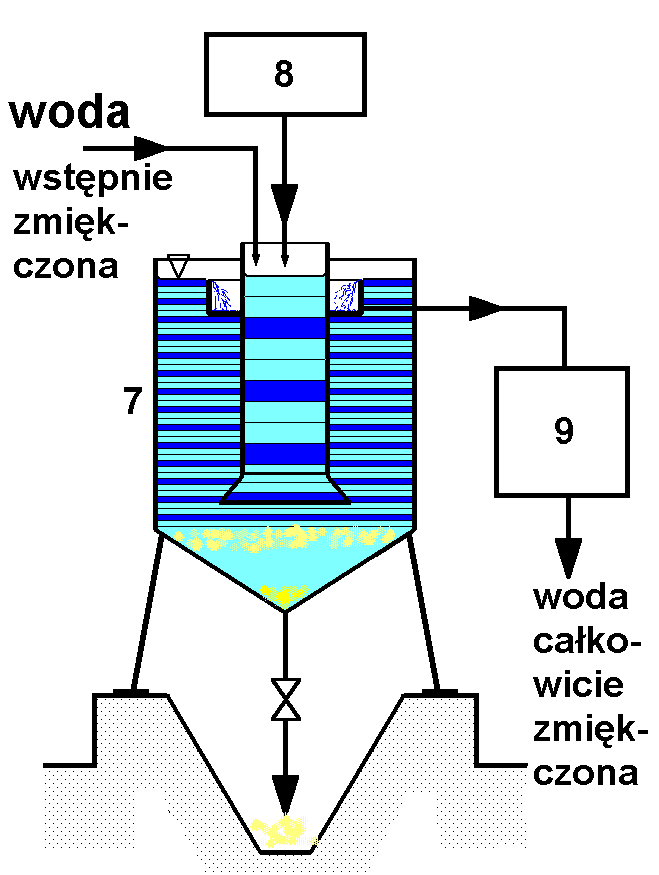
Schemat aparatu do zmiękczania fosforanami przedstawia rysunek poniżej.
Twardość szczątkowa uzyskana tą metodą wynosi ok. 0,03 mval/dm3.
Opis schematu: 7 - reaktor, 8 - zbiornik roztworu fosforanu sodowego, 9 - filtr wody całkowicie zmiękczonej
Działanie aparatury
Reaktor dziala w podobny sposób, jak opisany powyżej. Różnica jest podwyższona do ok 900 - 950 C temperatura reakcji, w ktorej proces przebiaga w sposób optymalny.
Dawkę fosforanu można oszacować na podstawie empirycznego wzoru:
gdzie: twnw - twardość niewęglanowa wody wstępnie zmiękczonej, tww - twardość węglanowa wody wstępnie zmiękczonej; obie wartości w [mval/dm3] [10]
Inne źródła podają tzw. wzór Haendelera:
gdzie oznaczenia jak powyżej, ale dawka wyrażana w [g/m3] zmiękczanej wody. [7]
Zmiękczanie fosforanami ma dodatkową zaletę - usuwa z wody także krzemionkę.
3CaSiO3 + 2Na3PO4 ==> Ca3(PO4)2 + 3Na2SiO3
Powstający krzemian sodowy nie tworzy kamienia krzemianowego, z punktu widzenia wymiany ciepła - osadu najbardziej niebezpiecznego.
Demineralizacja wody jest najskuteczniejsza po poddaniu jej destylacji lub podwójnej destylacji. Są to jednak procesy energochłonne i przez to kosztowne. Tańszym sposobem jest stosowanie wielostopniowych wyparek, w których para z pierwszego stopnia kondensując ogrzewa drugi stopień wyparny itd. Kolejne stopnie wyparne pracują pod niższym ciśnieniem i w niższej temperaturze.
Demineralizację można prowadzić również metodami elektrochemicznymi, takimi jak elektrodializa i elektroosmoza. Elektrodializa polega na dyfuzji elektrolitów przez porowatą przeponę przy udziale prądu elektrycznego. Elektroosmoza to ruch cieczy w porach diafragmy pod wpływem prądu elektrycznego. Obie metody stosuje się głównie do odsalania wody morskiej.
Jedną z metod zmiękczania lub demineralizacji wody (całkowitego usunięcia rozpuszczonych soli mineralnych i gazów) jest metoda jonitowa. Ze względu na jej użycie w czasie ćwiczenia omówimy ją szerzej.
Metoda jonitowa
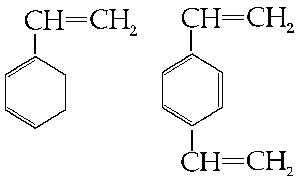
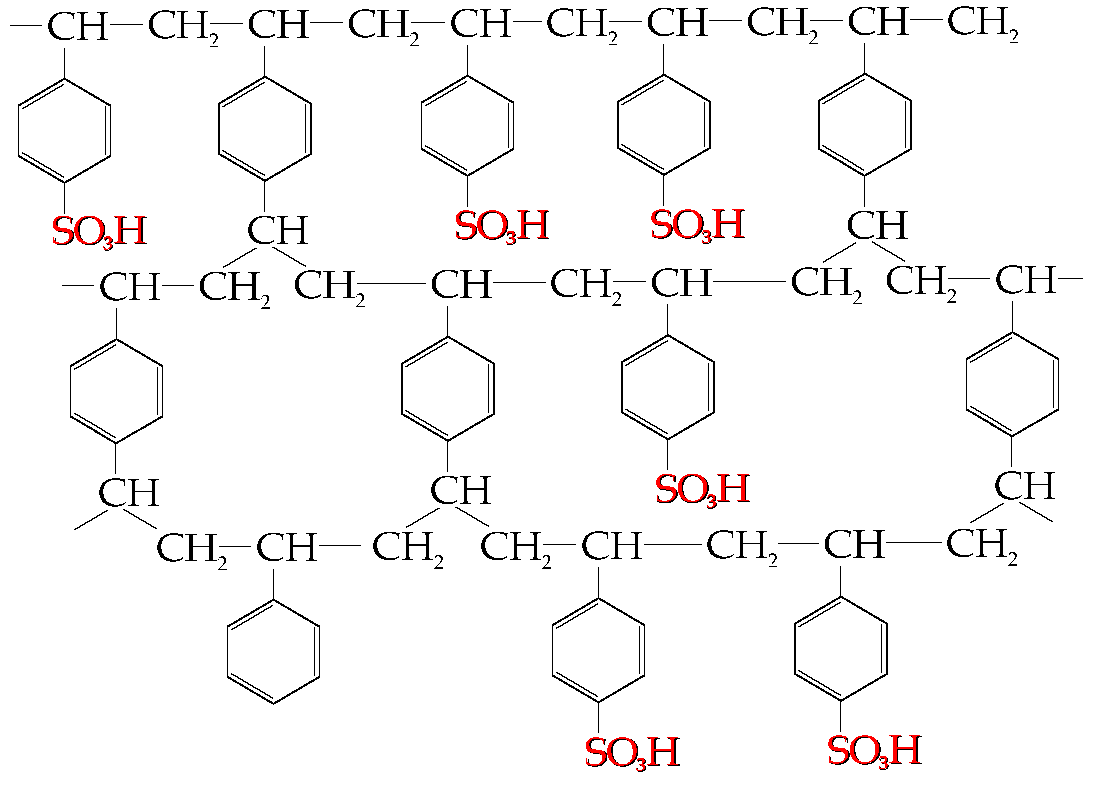
(Aby dokładnie obejrzeć wzór strukturalny, proszę kliknąć na obrazku w celu jego powiększenia. )
Rys. 2. Styren i diwinylobenzen
Rys.3. Kationit otrzymany przez sulfonowanie kopolimeru polistyren - diwinylobenzen. Dla powiększenia proszę kliknąć myszą. [5]
Rys. 4. Mer anionitu otrzymanego przez aminowanie kopolimeru styren-diwinylobenzen; forma chlorkowa. Mer pochodzący od diwinylobenzenu (sieciujący) niewidoczny
|
|
|
Jest to liczba milivali jonów, które mogą być wymienione
przez jednostkę masy lub objętości jonitu. Rozróżnia się całkowitą zdolność
wymienną i roboczą zdolność wymienną jonitów. Praktycznie wymianę jonową
prowadzi się do momentu osiągnięcia roboczej zdolności wymiennej, a następnie
jonity poddaje się regeneracji. Robocze zdolności wymienne jonitów wynoszą
od ok. 0,5 do 1,5 val/dm3.
Schematycznie przebieg wymiany można przedstawić następująco:
Demineralizacja jest to wymiana jonowa na jonitach pracujących w cyklu wodorowym. Jony Ca2+, Mg2+ i inne kationy wymieniane są na H+, a towarzyszące im aniony na jon OH-. Jonity, po wyczerpaniu swej zdolności jonowymiennej mogą być zregenerowane i ponownie użyte. |
Regeneracja
Kationit:
1/2Ca+2 Cl- + RSO3H RSO31/2Ca + H+Cl-Anionit:
Na+ A- + R-CH2N(CH3)3OH R-CH2N(CH3)3A + Na+OH-
Reakcje pokazują, że operacje dejonizacji biegną szeregowo (eluat z kationitu trafia do anionitu), natomiast reakcje regeneracji muszą biec równolegle (reagenty jednego nie mieszają się z reagentami drugiego jonitu). Ich mieszanie (nadmiarów) i cieczy płuczących należy przeprowadzić w neutralizatorze, reaktorze zbiorczym umieszczonym poza kolumnami jonitowymi. Produktem neutralizacji jest wodny roztwór NaCl i innych soli, wchodzących uprzednio w skład roztworu, jakim była woda niezdejonizowana. Stanowi on produkt odpadowy procesu dejonizacji.
Ta reguła nie obowiązuje podczas zmiękczania wody metodą jonitową. Reakcje mogą zachodzić w jednej kolumnie mieszanej zawierającej kationit w formie soli sodowej i anionit w formie chlorku, a cieczą regenerującą może być kilkuprocentowy roztwór NaCl w wodzie.
Zmiękczanie:
RSO3Na + R-CH2N(CH3)3Cl + 1/2Ca2+ HCO3- RSO31/2Ca2+ + R-CH2N(CH3)3HCO3 + Na+ + Cl-
Regeneracja:
RSO3Na + R-CH2N(CH3)3Cl + 1/2Ca2+ HCO3- RSO31/2Ca2+ + R-CH2N(CH3)3HCO3 + Na+ + Cl-
Aby zapewnić prawidłowy przebieg reakcji regeneracji, stężenie chlorku sodowego w roztworze regeneracyjnym powinno być wielokrotnie większe niż to, jakie powstaje podczas zmiękczania. Ten cykl pracy jonitów nazywany jest cyklem chlorkowo - sodowym.
Kolumny zmiękczające pracują nie tylko w dużych instalacjach przemysłowych, lecz także w urządzeniach domowych takich jak np. zmywarki do naczyń, tzw. filtrach do wody oraz indywidualnych domowych stacjach zmniejszających twardość wody, chociaż te ostatnie wypierane są przez inne, pracujące na zasadzie odwróconej osmozy.

Wkład do domowego filtra wody. Wkład zawiera mieszaninę kationitu w formie soli potasowej, anionitu w formie chlorkowej, węgla aktywnego i niekiedy srebra koloidalnego jako czynnika bakteriostatycznego. Wydajność wkładu (wg. producenta) - ok. 150 l wody, a zależy to odwrotnie proporcjonalnie do stopnia jej twardości. Wkłady w zasadzie nie nadają się do regenaracji.
Domowy filtr do zmiękczania, oczyszczania i dezynfekcji wody.
Zmywarka do naczyń. Otwór do sytnika solanki, którym dozowana jest tzw. sól regeneracyjna. Wymiennik jonitowy umieszczony we wnętrzu urządzenia zmiękcza wodę pobieraną do mycia, a w odpowiednich okresach cyklu zmywania jest regenerowany wodnym roztworem NaCl.
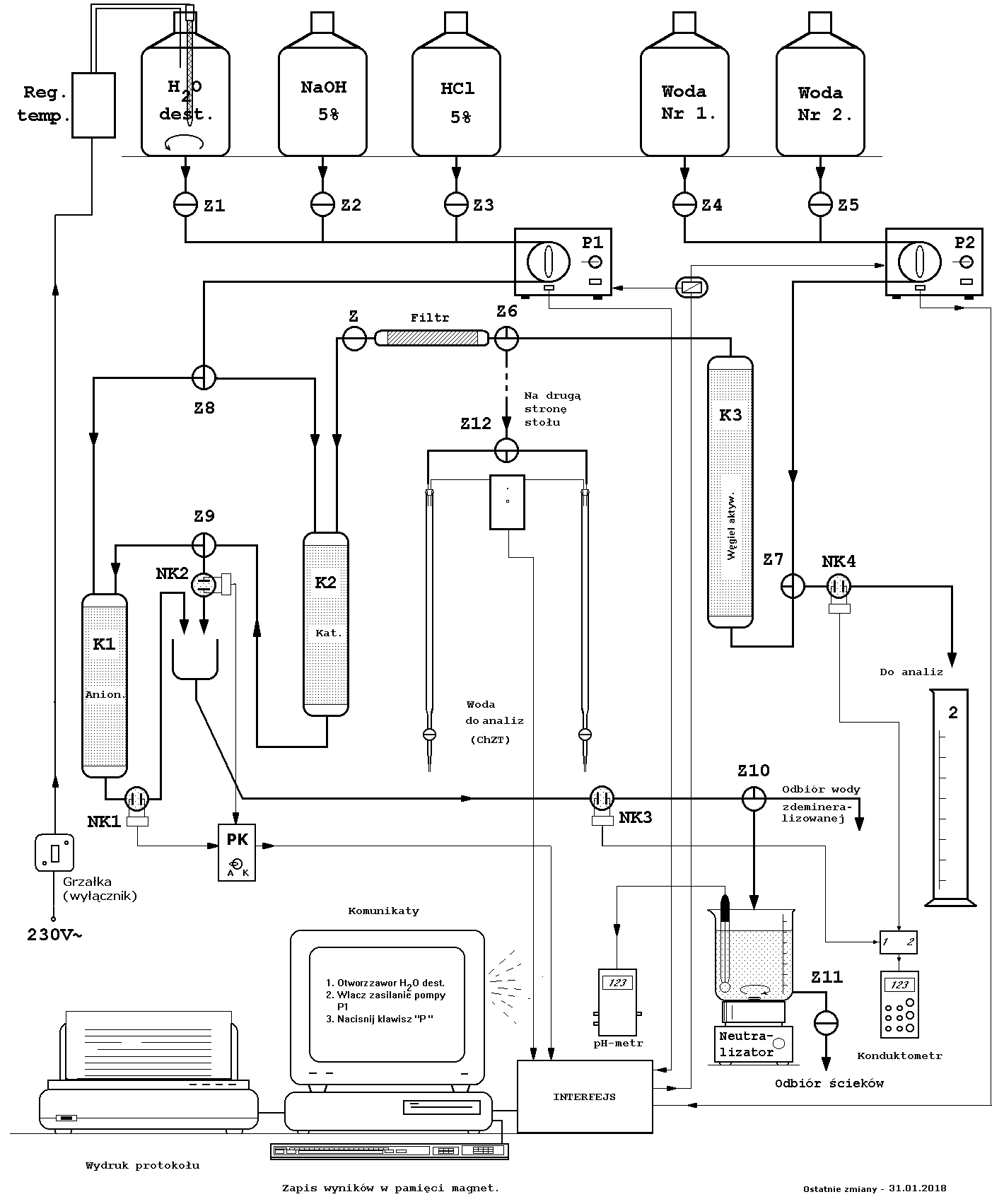
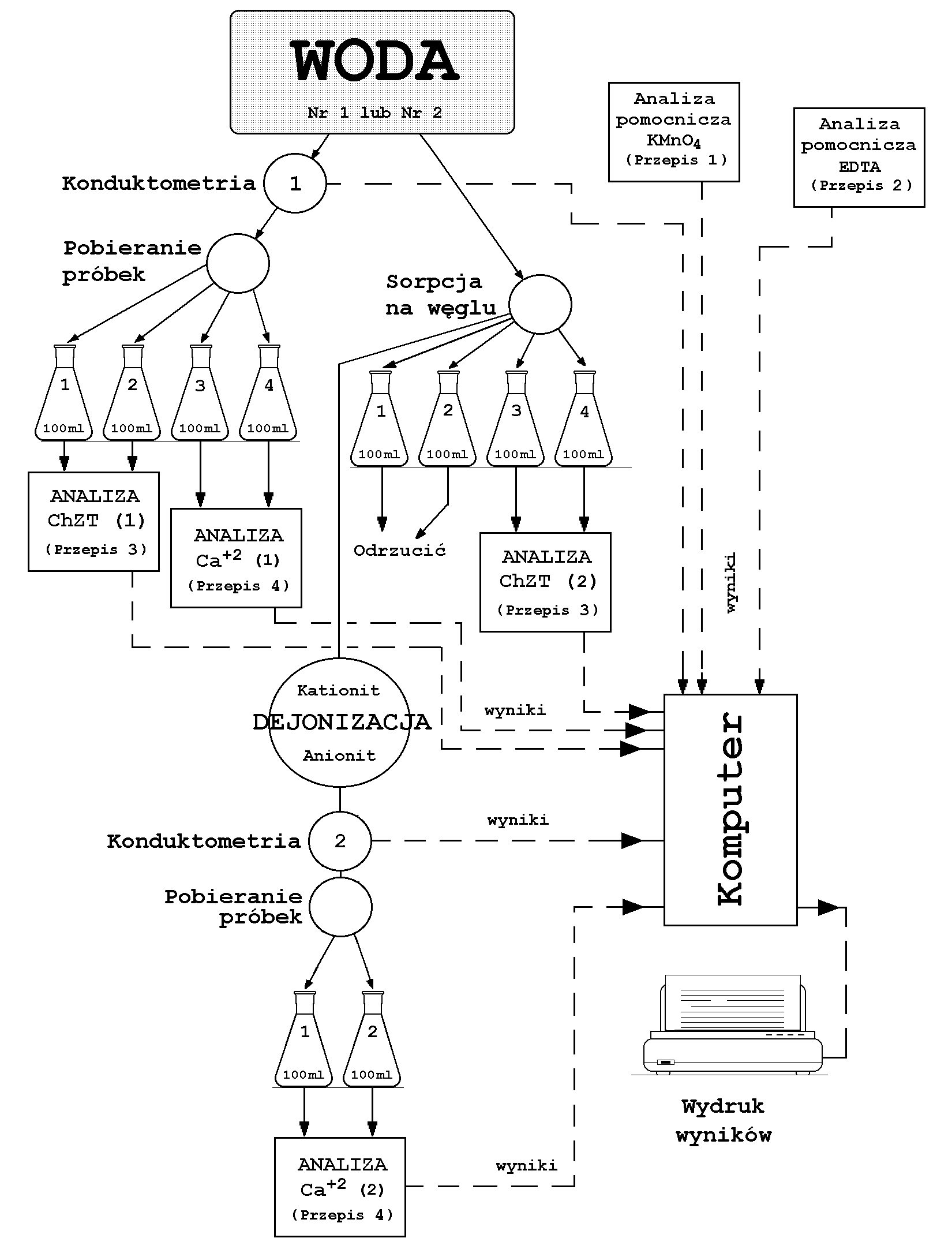
Przebieg ćwiczenia.
Część procesowa
a) Regeneracja jonitów
Pierwszą operacją, jaką należy wykonać jest regeneracja jonitów. Jonity pracują w cyklu wodorowo - wodorotlenowym. Do regeneracji kationitu używa się 5% roztworu kwasu solnego, a do anionitu 5% roztworu wodorotlenku sodu. Regeneracja polega na przetłaczaniu odpowiednich roztworów przez złoża jonitów znajdujących się w kolumnach. Po ustawieniu odpowiednich zaworów roztwory ze zbiorników tłoczy pompa perystaltyczna. Eluat kontrolowany jest konduktometrem. Pojawienie się w eluacie mocnego elektrolitu jakim są roztwory regenerujące świadczy o zakończeniu procesu regeneracji. Następnie należy odmywać nadmiar roztworów regenerujących pozostających w złożu za pomocą podgrzanej wody destylowanej. Wodę do przemywania tłoczy się ze zbiornika tą samą pompą, co roztwory regenerujące. Różnica polega na odpowiednim ustawieniu zaworów łączących. O zakończeniu odmywania świadczy obojętny odczyn eluatu i zanik przewodnictwa elektrycznego. Konduktometr umożliwia dokładną ocenę tego stanu i przesyła informację do komputera. Komputer zatrzymuje operację gdy przewodnictwo eluatu osiągnie wartość ok. 5 μS/cm.
Roztwory regenerujące i płuczące, kwaśne i zasadowe są neutralizowane w neutralizatorze. Ich odczyn jest kontrolowany za pomocą pehametru. Komputer przypomina ćwiczącemu o okresowych odczytach wartości pH ścieków. Kiedy pH osiąga wartość 6 - 8, poleca zrzut ścieków ( 2 - 5% roztwór NaCl) do kanalizacji. Aby obejrzeć animowane schematy KLIKNIJ TU
b) Uzdatnianie wody
| Uzdatnianą wodę pobieraną ze zbiornika należy oczyścić
przetłaczając ją przez kolumnę wypełnioną węglem aktywnym. Kolumna o pojemności ok. 0,370 l i wysokości ok. 0,75 m wypełniona jest węglem aktywnym SAR-1A zawierającym srebro w ilości ok. 0,3% jako substancję bakteriostatyczną*.
Przed oczyszczeniem i po jego wykonaniu pobrać próbki do oznaczania parametru ChZT. Dokładny sposób postępowania podawany jest na monitorze komputera. Schemat prac analitycznych przedstawia rys. 6. Następnie oczyszczoną wodę należy skierować przez filtr - zatrzymujący drobne zanieczyszczenia mechaniczne i glony - do kolumny kationitowej, a stąd do kolumny anionitowej. Eluat wypływający z kolumny anionitowej przepływa do czujnika konduktometrycznego i odbieralników. Z odbieralników pobierać próbki do oznaczania twardości szczątkowej. Jednocześnie prowadzi się pomiary przewodności elektrycznej wody uzdatnionej w funkcji jej objętości. Również i tu komputer sygnalizuje ćwiczącemu moment kolejnego pomiaru, a ćwiczący wprowadza wynik za pomocą klawiatury. Zmiana nachylenia krzywej przewodnictwa wskazuje na zużycie złoża jonitowego. Pozwoli to na późniejsze wyznaczenie roboczej zdolności wymiennej kolumny. W aparaturze do ćwiczenia pracują jonity, których charakterystykę zawiera poniższa tabela: ____________________________________ * wg danych producenta |
|
Masa - 6,26 g do 05.03.2019 r. |
Częsć analityczna .
W czasie wykonywania analiz studenci posługują się roztworami, które pozostają nieobojętne dla zdrowia wykonującego. Należy zatem ściśle przestrzegać przepisów BHP obowiązujących w Pracowni. Przy pracy z roztworami żrącymi należy używać okularów i rękawic ochronnych. Przy pipetowaniu - do zaciągania roztworów używać pompek lub gruszek. Podczas ogrzewania naczyń w łaźni wodnej zachować odpowiednią ostrożność. Wszystkie roztwory poanalityczne wylewać do specjalnie do tego przygotowanego pojemnika, znajdującego się pod wyciągiem.
Poza tym na pracowni zabrania się jedzenia, picia, palenia tytoniu, a przerwę na posiłek należy ustalić z prowadzącym ćwiczenie. Wszystkie odczynniki chemiczne używane w tym ćwiczeniu i wymienione w tekście instrukcji mają zaprogramowane " linki" do baz danych dotyczących ich właściwości, oddziaływania na człowieka i sposobu postępowania w przypadku wystąpienia zagrożenia. Wskazane jest, aby zapoznać się z tymi danymi przed przystąpieniem do ćwiczenia.
Rys. 6. Schemat prac analitycznych. Dla powiększenia proszę kliknąć myszą.

Rys. 6.A. Stanowisko do analiz miareczkowych - biurety Pelleta. Aby napełnić biuretę, należy zamknąć zawory Z1 (Z5) i Z2 (Z4), zawór trójdrożny Z3 ustawić w położenie umożliwiające wtłaczanie powietrza do butli B1 lub B2, (albo obu na raz), włączyć zasilanie kompresora powietrza P i obserwować napełnianie biurety (biuret) roztworem titranta. Kiedy poziom roztworu przekroczy "0" na skali biurety, odpowietrzyć układ otwierając zawór Z2 (Z4) i wyłączyć zasilanie pompki. Nadmiar titranta zostanie odlewarowany, a poziom zerowy ustali się samoczynnie. Dla powiększenia rysunku proszę kliknąć myszą.
Przepisy analityczne opracowane w wersjach uproszczonych
na podstawie Polskich Norm PN-85/045578/02 (ChZT)
i PN-91/C-04551/01 (oznaczanie wapnia).
Przepis 1 - Oznaczanie miana roztworu KMnO4 Do dwóch kolb stożkowych o pojemności 250 lub 300 cm3 odmierzyć pipetą po 100,0 cm3 wody destylowanej.
Do wody dodać:
10 cm3 H2SO4(1 cz obj. kwasu + 3 cz. obj. wody dest. - roztwór jest przygotowany) - odmierzyć cylindrem
10,0 cm3 0,0125 N tj. 0,0625 mol/dm3 roztworu KMnO4 - odmierzyć biuretąZawartość kolb wymieszać, wstawić do wrzącej łaźni wodnej i ogrzewać przez 30 minut.
Ponizej schemat ułatwiający zrozumienie objetościowego bilansu analiz manganometrycznych przy założeniu, że stężenia molowe reagentów są dobrane jak 1 : 2,5.Zamieszać i do gorącego dodawać z biurety roztwór KMnO4 aż do powstania bardzo słabo różowego zabarwienia utrzymującego się przez 1 - 2 minuty, co wskazuje na punkt równoważnikowy (końcowy) miareczkowania.
Do kolb ponownie odpipetować po 10,0 cm3 0,0125 N t.j. 0,025 mol/dm3 roztworu (COONa)2 i ponownie miareczkować do powstania bardzo słabo różowego zabarwienia utrzymującego się przez 1 - 2 minuty.
Zapisać objętości roztworu KMnO4 z powtórnych miareczkowań do arkusza wyników. Wyliczyć średnią arytmetyczną.
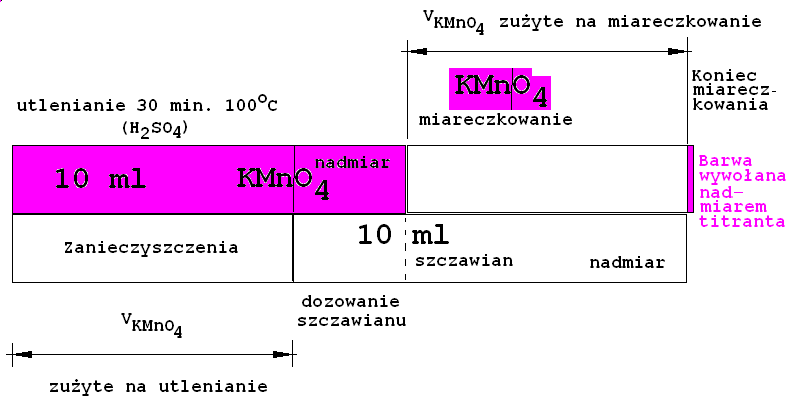
W czasie miareczkowania zachodzi reakcja:
2KMnO4 + 5Na2C2O4 + 8H2SO4 2MnSO4 + 5Na2SO4 + 8H2O +10CO2+ K2SO4
Można ją również zapisać jonowo:
Mangan przechodząc ze stopnia utlenienia +7 na +2 redukuje się, jest więc utleniaczem. Jon szczawianowy przechodząc z -2 do cząsteczkowego CO2 utlenia się, jest więc reduktorem.
Przepis 2 - Oznaczanie miana 0.01 M roztworu Na2[EDTA] 1. Do dwóch kolb stożkowych o pojemności 200 - 300 cm3 odpipetować po 10,0 cm3 0,01 mol/dm3 roztworu CaCl2 (oznaczony na butelce jako Ca+2 0,40 mg/cm3 )2. Do roztworów dodać ok.
a) 100 cm3 wody destylowanejc) 200 mg kalcesu* (wskaźnik) - tj. 2...3 łopatki. Zawartość kolby mieszać do całkowitego rozpuszczenia wskaźnika
b) 3 cm3 24% roztworuKOH 3. Miareczkować roztworem Na2[EDTA] do zmiany barwy z różowej na niebieską.
4. Wyniki zanotować w arkuszu wyników, obliczyć średnią arytmetyczną.
________________* - kalces, sól sodowa kwasu 2-hydroksy-1-(2-hydroksy-4-sulfo-1-naftyloazo)-3-naftoesowego Analiza jest oparta o specyficzny typ reakcji chemicznych - tworzenia związków koordynacyjnych. [2] Zawierają one atom lub jon centralny otoczony zespołem jonów lub cząsteczek zwanych ligandami. Oprócz ligandów prostych zawierających jeden atom będący donorem par elektronowych istnieje grupa ligandow zawierających dwa lub więcej takich atomów. Takie ugrupowania nazywa się mianem ligandu chelatującego, a kompleksy - chelatami. Przykładem ligandu chelatującego może być [EDTA] , wersenian, (najczęściej jako sól disodowa kwasu etylenodiaminotetraoctowego. Posiada on 6 atomów donorowych (4O i 2N), zajmuje 6 miejsc koordynacyjnych metalu tworząc kompleks 1:1, niezależnie od wartościowości jonu centralnego.
Jego wzór przedstawia się następująco:
Różne związki kompleksowe odznaczają się różną trwałością. Trwałość opisywana jest wartością K, zwaną stałą trwałości. Jeśli jon (atom) tworzy z pewnym ligandem kompleks o stałej K1, a z innym kompleks o stałej K2, przy czym K2 > K1, to po dodaniu do roztworu pierwszego kompleksu innego roztworu zawierającego drugi ligand nastąpi wymiana i uwolnienie związku zawierającego pierwszy ligand.
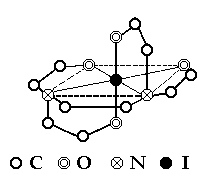
Rys. 7. Struktura przestrzenna kompleksu EDTA z jonem centralnym I. Linie przerywane nie stanowią wiązań chemicznych. Pomagają zrozumieć układ przestrzenny cząsteczki. [4].
Przepis 3 - Oznaczanie ChZT wody badanej
1. Do dwóch kolb stożkowych o pojemności 200 - 300 cm3 odmierzyć pipetą lub biuretą po 100,0 cm3 wody badanej.
Do wody dodać:
a) 10 cm3 H2SO4 (1 cz obj. kwasu + 3 cz. obj. wody dest.) - odmierzając cylindrem
b) 10,0 cm3 0,0125 N t.j. 0,0625 mol/dm3 roztworu KMnO4- odmierzając biuretąZawartość kolb wymieszać, wstawić do wrzącej łaźni wodnej i ogrzewać przez 30 minut.
Przepis 4 - Oznaczanie jonów Ca+2
2. Po wyjęciu kolb z łaźni natychmiast odpipetować do nich po 10.0 cm3 0,0125 N t.j. 0,025 mol/dm3 roztworu (COONa)23. Zamieszać i do gorącego dodawać z biurety roztwór KMnO4 aż do powstania słabo różowego zabarwienia utrzymującego się przez 1 - 2 minuty.
4. Zapisać objętość roztworu KMnO4 do arkusza wyników. Zużycie roztworu KMnO4 powinno wynosić od 2 do 8cm3. O ile warunek ten nie jest spełniony, oznaczenie powtórzyć stosując próbkę o odpowiednio skorygowanym stężeniu.Obliczyć średnią arytmetyczną.Reakcja zachodząca w tym przypadku jest taka sama jak w przepisie 1. Reakcja (COONa)2 z nadmiarem KMnO4 jest konkurencyjna w stosunku do reakcji utleniania związków utlenialnych w czasie ogrzewania próbki. Pozostający nadmiar (COONa)2 jest ilościowo równy ich zawartości w próbce. Pozwala zatem na ich oznaczenie.
Przygotowanie próbek
1. Dwie próbki wody po 100,0 cm3 odmierzone pipetą z cylindra Nr 2 umiecić w kolbach Erlenmeyera o pojemności 200 - 300 cm3 i zakwasić kilkoma kroplamikwasu azotowego do pH 2 wobec papierka wskaźnikowego. W przypadku Analizy 2 (woda po demineralizacji pobierana z zaworu Z10) wody nie zakwaszać. 2. Do próbki odmierzyć :
a) cylindrem ok. 20 cm3 trietanoloaminy w celu zamaskowania jonów żelaza, glinu i manganu. W przypadku Analizy 2 ten podpunkt pominąć.
b) pipetą wielomiarową ok. 3 cm3 24% roztworu KOH .c) łopatką ok. 200 mg kalcesu (dwie - łopatki). 3. Próbkę wymieszać do całkowitego rozpuszczenia kalcesu.
Wykonanie oznaczenia 1. Próbkę miareczkować od razu roztworem Na2[EDTA] do zmiany zabarwienia z różowego na niebieski.
2. Za wynik końcowy oznaczenia przyjąć średnią arytmetyczną dwóch oznaczeń różniących się nie więcej niż 5% wyniku mniejszego.
3. Wynik wpisać do arkusza wyników.
|
|
|
Po zakończeniu demineralizacji wody program komputerowy
sterujący instalacją przechodzi samoczynnie do części
obliczeniowej. W myśl poleceń ukazujących się na ekranie monitora należy
wprowadzać poprzez klawiaturę wyniki analiz miareczkowych. Program wylicza
zawartość początkową jonów wapniowych w wodzie uzdatnianej, ich zawartość
szczątkową w wodzie zdemineralizowanej, a także twardość wapniową przeliczoną
na mg CaCO3/dm3. Wylicza
także w % skuteczność usuwania jonów wapniowych.
W drugiej części obliczeń wylicza ChZT wody uzdatnianej i ChZT wody oczyszczonej w kolumnie z zawartością węgla aktywowanego. Również w tym przypadku wylicza procentową redukcję ChZT wskutek działania kolumny węglowej. Wszystkie wyniki obliczeń są następnie zapisywane samoczynnie na dysku i drukowane w końcowej części Protokołu Ćwiczenia. W przypadku, kiedy nie byłoby możliwości wykonania powyższych obliczeń za pomocą programu komputerowego, należy posłużyć się wzorami zawartymi w Polskich Normach nr PN-91/C-04551/ (odpowiadająca normie ISO 6058-1984) dla obliczenia zawartości wapnia i normy nr PN-85/C-04578/02 - oznaczania ChZT metodą nadmanganianową. Oznaczanie zawartości wapnia a) miano roztworu wersenianu dwusodowego (k) w przeliczeniu
na wapń obliczyć w mg/cm3
wg wzoru A
gdzie: V - objętość roztworu wersenianu użyta do miareczkowania roztworu wzorcowego CaCl2 [cm3] b) zawartosć wapnia w badanej próbce (X1) obliczyć wg wzoru B gdzie: V - objętość roztworu wersenianu użyta do miareczkowania [cm3], k - miano roztworu wersenianu, V1 - objętość badanej próbki (w ćwiczeniu - 100,0 cm3) c) twardosć wapniową (X2) wyrażoną w mg CaCO3 /dm3 obliczyć wg wzoru C gdzie: X1 - zawartosć wapnia, 2,5 - współczynnik przeliczeniowy
ChZT badanej próbki (X1)
jako tlen w mg/dm3 obliczyć wg wzoru:
gdzie: V1 - objętość roztworu KMnO4 zużyta do miareczkowania próbki [cm3], V - objętość roztworu KMnO4 zużyta do miareczkowania 10,0 cm3 roztworu szczawianu sodu [cm3], 10 - przelicznik Wyniki pomiarów przewodności elektrolitycznej - konduktancji wody uzdatnianej i zdemineralizowanej są również przeliczane jako skuteczność działania jonitów. W czasie trwania demineralizacji komputer wzywa do okresowych pomiarów konduktancji (konduktometr CC-411). Wyniki pomiarów należy wprowadzać poprzez klawiaturę, a w Protokole Ćwiczenia pojawia się wydruk zależności konduktancji od objętości wody zdemineralizowanej. Pomiar objętości wody dokonywany jest samoczynnie przez układ pompa tłocząca II - komputer. Wydruk jest źródłem danych do sporządzenia wykresu tej zależności w układzie współrzędnych prostokątnych. Wykres przedstawia przykładowy przebieg zmian konduktancji w funkcji objętości wody zdemineralizowanej.Wykorzystując go należy wyznaczyć roboczą zdolność wymienną układu kolumn jonitowych. |
|
|
|
Aby graficznie, a następnie rachunkowo
wyznaczyć roboczą zdolność wymienną posłużyć
się można programem MS Excel, umożliwiającym przeprowadzenie procedur aproksymacyjnych.
Na krzywej przedstawionej na wykresie
można wyodrębnić dwa odcinki: plateau, kiedy jonity są w pełni aktywne,
a konduktancja wody zdemineralizowanej utrzymuje się na stałym, niskim
poziomie (rzędu kilku µS/cm) i szybkiego wzrostu konduktancji ilustrujący
zwiększanie stężenia jonów w eluacie. Sygnalizuje on stan wyczerpywania
się jonitów. Pomiędzy nimi znajduje się obszar przejściowy.
W praktyce, gdy krzywa
przyjmuje kształt jak na wykresie można
również wyznaczyć ten punkt. W tym celu należy poprowadzić dwie proste "dopasowane" do wyróżnionych wyżej odcinków krzywej, przedłużyć je aż do przecięcia, a współrzędną X
punktu ich przecięcia uznać za objętość wody o znanej twardości początkowej
odpowiadającą roboczej
zdolności wymiennej. Więcej na temat metod "dopasowania" można poczytać klikając tutaj.
Program umożliwia przeprowadzenie tych operacji i wyznaczenie równań dla prostych w formie y=ax+b. Ponieważ wartość obu funkcji w punkcie przecięcia jest sobie równa, można prosto wyznaczyć wartość x z układu tych równań. W przypadku użycia programu MSExcel dane pomiarowe należy wstępnie podzielić na dwie części odpowiadające odcinkowi plateau i odcinkowi szybko rosnącemu, a następnie wygenerować linie trendu dla 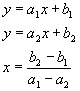 każdego z nich. W końcu wyświetlić liniowe równania opisujące linie trendu. każdego z nich. W końcu wyświetlić liniowe równania opisujące linie trendu.Objętość x pomnożona przez początkowe stężenie jonów w wodzie nieuzdatnionej i przez % skuteczności demineralizacji daje wynik w postaci ich masy, a podzielona przez masę użytych jonitów jednostkową zdolność wymienną. W naszym przypadku uwzględniamy masę kationitu, gdyż analizujemy kationy Ca2+ . W bardziej uniwersalny sposób zdolność wymienną można wyrazić w [mval/g] dzieląc powyższy wynik przez 20.04 (40,08 - masa molowa jonu podzielona przez 2 - wartościowość wapnia). Trzeba jednak zdawać sobie sprawę, że rzeczywista zdolność robocza jest większa, gdyż oprócz kationów wapnia w wodzie zawarte są kationy magnezu, sodu, żelaza, manganu itd., których zawartości nie analizujemy. 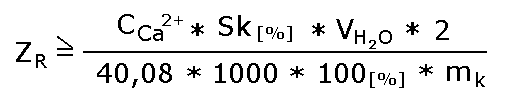
gdzie: ZR - robocza zdolność wymienna [ mval/g ] CCa2+ - stężenie jonów Ca2+ w wodzie surowej [mg/l] Sk[%] - procentowa skuteczność demineralizacji wyliczona przez komputer C64 VH2O - objętość wody X wyliczona z rozwiązania układu równań linii trendu lub w przypadku nieuzyskania przebicia kolumn - maksymalna objętość wody zdejonizowanej V uzyskana w czasie ćwiczenia [ ml ] 2 - wartościowość wapnia 40,08 - masa milimola jonów wapniowych [ mg ] 1000 - przelicznik mililitrów na litry 100 - dzielnik przy obliczaniu masy jonów wapnia z uwzględnieniem skuteczności [ % ] mk - aktualna masa kationitu Robocza zdolność wymienna pozwala
na określenie objętości wody o znanej zawartości jonów, którą można zdejonizować
bez pogorszenia jakości uzyskiwanego produktu, a następnie rozpocząć operacje
pomocnicze: regenerację i odmywanie nadmiaru roztworów regenerujących.
Aby wyliczyć zdolność jonowymienną roboczą, proszę wpisać dane do poniższego arkusza i odczytać wynik. Przeglądarki oparte o system Mozilla (Firefox, Netscape) nie wyświetlają prawidłowo tego okna. Uruchamiają oddzielnie arkusz kalkulacyjny MS Excel.
|
|
|
| przygotować wg poniższego wzoru: |
| Sprawozdanie z ćwiczenia nr. 3 | Data wykonania ćwiczenia |
| Asystent prowadzący ćwiczenie: mgr Adam Mysliński | Data oddania sprawozdania |
| Wykonujący ćwiczenie: | Nr grupy |
| Tytuł ćwiczenia: Uzdatnianie wody |
|
| 1. Cel ćwiczenia.
2. Przestudiowana literatura dotycząca ćwiczenia. 3. Teoretyczne podstawy eksperymentu. 4. Opis eksperymentu zawierający: a) blokowy (uproszczony) schemat aparatury.5. Opracowanie wyników: a) równania reakcji,6) Dyskusja otrzymanych wyników. 7) Wnioski ( między innymi, czy cel ćwiczenia został osiągnięty). |
. |
|
Opis należy dostarczyć do prowadzącego ćwiczenie nie później niż dwa tygodnie od
dnia wykonania ćwiczenia. Forma opisu - plik w formacie MSWord (*.doc , *.docx lub *.rtf) należy nadesłać jako załącznik pod adresem: admys@chem.uw.edu.pl
|
|
|
|
2. Procesy technologiczne stosowane przy uzdatnianiu wody do zastosowań przemysłowych i laboratoryjnych - ogólna charakterystyka oraz szczegółowo:
3. Wymagania jakościowe stawiane wodzie przeznaczonej na cele bytowo-gospodarcze, do celów przemysłowych i dla rolnictwa. 4. Oczyszczanie wody przeznaczonej na cele bytowo-gospodarcze [10]. 5. Znajomość przebiegu ćwiczenia, wykazanie zrozumienia
metod analitycznych stosowanych w ramach ćwiczenia: miareczkowanie wykorzystujące
reakcje redox, kompleksowania,
konduktometria,
pehametria.
|
|
|
|
1. Podręcznik do ćwiczeń z technologii chemicznej,
Praca zbiorowa pod red. nauk. prof. dr hab. Teresy Kasprzyckiej-Gutmann,
Wydawnictwa Uniwersytetu Warszawskiego, Warszawa 1996 ISBN Literatura uzupełniająca: 11. "Geneza
i rozwój inżynierii miejskiej", Janczewski Henryk, Rozdział
4: "Zaopatrzenie Warszawy w wodę", Wyd. Arkady, Warszawa 1971
Sekwencja video - Katarzyna
Skupińska, Wiesława Skupińska |
| Powrót |